L'architecture de la coiffe stabilisatrice des microtubules dévoilée
Publié par Isabelle,
Source: CNRS-INSBAutres langues:
Source: CNRS-INSBAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
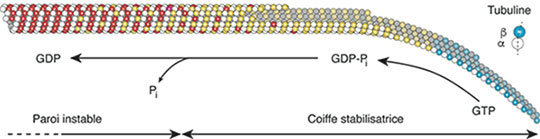
Figure: La tubuline liée au GTP (?-tubuline-GTP en bleu) polymérise sous forme de feuillets courbes à l'extrémité des microtubules. Ces feuillets se redressent progressivement et se referment en tube. Lors de ce processus, la tubuline hydrolyse une molécule de GTP en GDP (?-tubuline-GDP en rouge). Ce mécanisme impliquerait la formation d'un intermédiaire tubuline-GDP-Pi (?-tubuline-GDP en jaune) participant à la structure de la coiffe stabilisatrice des microtubules. Après relargage du phosphate inorganique (Pi), la paroi formée de molécules de tubuline-GDP est dans un état instable, et l'ensemble de l'édifice est maintenu par la coiffe de molécules de tubuline-GTP et -GDP-Pi à son extrémité en croissance. La perte aléatoire de cette coiffe serait à l'origine des évènements stochastiques de dépolymérisation rapide (dénommés "catastrophes") caractéristiques de l'instabilité dynamique des microtubules, et sa reformation permettrait les évènements inverses (dénommés "sauvetages").
© Denis Chrétien
Les microtubules sont des polymères biologiques extrêmement dynamiques d'environ 25 nm de diamètre et pouvant atteindre plusieurs dizaines de micromètres de longueur, et qui s'assemblent à partir d'une protéine, la tubuline, constituée de deux sous unités (a,b). Ils participent à de nombreuses fonctions essentielles telles que l'organisation interne du cytoplasme, la motilité cellulaire, le trafic de vésicules intracellulaires, ou encore la division cellulaire grâce à la formation d'une structure particulière, le fuseau mitotique, qui ségrége les chromosomes de façon équitable dans les deux cellules filles.
Une particularité de ce polymère réside dans sa faculté de pouvoir alterner rapidement et de façon autonome entre des phases de croissance et de décroissance, un phénomène dénommé "instabilité dynamique", et dont les mécanismes ne sont pas encore totalement élucidés. La tubuline utilise une molécule de guanosine triphosphate (GTP) dont l'hydrolyse de la liaison entre deux atomes de phosphate apporte de l'énergie aux microtubules. Cependant, cette énergie n'est pas nécessaire à leur assemblage, mais s'accumule sous forme d'énergie mécanique dans leur paroi devenue ainsi hautement instable, à la manière d'un ressort mis sous tension: l'extrémité des microtubules doit donc être protégée par une coiffe stabilisatrice prévenant leur dépolymérisation rapide, mais qui n'avait à ce jour jamais été visualisée à l'échelle moléculaire.
Pour mettre en évidence la coiffe stabilisatrice présente à l'extrémité des microtubules en croissance, les chercheurs ont utilisé la protéine EB1 (end-binding protein 1) qui présente une forte affinité pour cette région du microtubule. Cependant, cette protéine est trop petite pour être visualisée directement par microscopie électronique. Pour s'affranchir de cette limitation, ils ont conjugué EB1 à des nanoparticules d'or denses aux électrons. Ils ont ensuite congelé rapidement des microtubules en cours d'assemblage dans de l'éthane liquide (environ -184°C) et les ont imagés par cryo-tomographie électronique. Les résultats montrent qu'EB1 se lie aux feuillets courbes ainsi qu'à une partie de la paroi refermée des microtubules. Ils ont ensuite analysé la structure d'extrémités de microtubules assemblés en présence d'analogue du GTP, et ont montré que quelle que soit la nature du nucléotide utilisé, la tubuline subissait un changement de conformation courbe->droit probablement impliqué dans l'hydrolyse du GTP.
L'instabilité dynamique confère une grande labilité aux réseaux de microtubules cellulaires, et leur permet ainsi de se réorganiser rapidement en fonction des besoins de la cellule. Ce mécanisme est précisément régulé par un ensemble de protéines au cours du cycle et de l'activité cellulaire, et peut être modulé par des molécules à activité pharmaceutique telles que les taxoïdes utilisés dans le traitement de cancers. Ces molécules agissent à des concentrations substoechiométriques en se liant à l'extrémité des microtubules en croissance, et donc à la coiffe stabilisatrice des microtubules mise en évidence au cours de cette étude.
Publication:
EB1 interacts with outwardly curved and straight regions of the microtubule lattice.
Guesdon A, Bazile F, Buey RM, Mohan R, Monier S, García RR, Angevin M, Heichette C, Wieneke R, Tampé R, Duchesne L, Akhmanova A, Steinmetz MO, Chrétien D.
Nat Cell Biol. 2016 Sep 12. doi: 10.1038/ncb3412.