Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
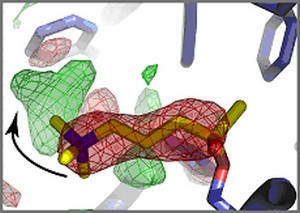
Lors de la coupure de l'analogue du neurotransmetteur acétylcholine (bâtonnets jaune)
dans le site actif de l'acetylcholinestéras (bâtonnets bleu), la choline,
un des deux produits du clivage, se réoriente dans le site actif de l'enzyme.
La réorientation de la choline est schématisée par la flèche noire:
elle passe de la position en rouge à la position en vert
L'acétylcholinestérase est une enzyme essentielle à la transmission du signal nerveux, en charge notamment des fonctions cognitives (mémoire, jugement, langage, ...), qui sont affectées au cours de la maladie d'Alzheimer. Ainsi, la plupart des traitements actuellement disponibles ont pour cible l'acétylcholinestérase, dont la fonction est la dégradation spécifique et très rapide d'un neurotransmetteur, l'acétylcholine, qu'elle coupe en deux parties, terminant ainsi la transmission des influx nerveux. Cette réaction est appelée clivage enzymatique.
Les chercheurs de l'IBS ont réussi à observer l'acétylcholinestérase au cours de la dégradation du neurotransmetteur en utilisant une méthode originale qui permet d'initier et de suivre la réaction de clivage par absorption et diffraction des rayons X. Pour ce faire, ils ont du surmonter plusieurs obstacles. Tout d'abord, pour observer l'enzyme en action, il était nécessaire de maîtriser le démarrage de la réaction. Dans cette optique, les chercheurs de l'IBS ont utilisé de manière détournée les capacités du synchrotron européen (ESRF, Grenoble) (3) et notamment le fait que son rayonnement puissant a pour effet secondaire de provoquer des cassures sur les molécules observées. Ils se sont servis de cette propriété pour créer une cassure ciblée dans un analogue (4) de l'acétylcholine, simulant de la sorte l'étape de coupure par l'enzyme. Cette dernière adopte alors, au moment choisi par les chercheurs, la conformation (5) qu'elle prend naturellement après avoir joué son rôle de "ciseaux moléculaires". Le synchrotron est ainsi utilisé à la fois pour créer la cassure et pour observer la structure de l'enzyme. La deuxième difficulté qu'ont dû résoudre les scientifiques est qu'à température ambiante les changements de conformation qui accompagnent cette réaction sont très rapides (quelques millisecondes). L'utilisation de températures cryogéniques comprise entre -120 et -170°C, a permis de résoudre ce problème en ralentissant significativement la réaction de façon à analyser successivement les différentes conformations adoptées par l'acétylcholinestérase au cours d'une des réactions de clivage enzymatique les plus rapides de la nature.
Certains médicaments agissent en piégeant leur cible dans une conformation bien particulière. La connaissance de l'ensemble des conformations pouvant être adoptées par une enzyme peut donc mener à une conception rationnelle de molécules plus efficaces. Ces résultats ouvrent de nouvelles pistes pour le développement de la deuxième génération de médicaments anti-Alzheimer.
Notes:
(1) IBS, Institut mixte CEA-CNRS-Université Joseph Fourier, Grenoble
(2) Avec le soutien de l'Institut de Pharmacologie et de Biologie Structurale à Toulouse et du synchrotron européen (ESRF) de Grenoble
(3) Synchrotron européen: microscope géant utilisant un rayonnement lumineux intense pour observer des nano-objets
(4) Molécule mimant le neurotransmetteur
(5) Conformation: structure d'une protéine en trois dimensions