Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Chez la plupart des mammifères, le développement du testicule est régulé par l'expression d'une cascade de gènes initiée par le gène SRY dont l'action est relayée par le produit du gène SOX9. Par contraste, le développement ovarien a longtemps été considéré comme une voie par défaut, activée passivement en l'absence de l'expression de SRY chez la femelle. Au cours des années dernières, ce point de vue a été remis en question par des travaux ayant montré que les gènes "testiculaires" sont réprimés constamment dans l'ovaire depuis le stade embryonnaire jusqu'à l'âge adulte. Une étude de l'équipe de Reiner Veitia à l'Institut Jacques Monod, publiée dans la revue eLIFE, apporte de nouvelles données qui confortent cette idée et éclaire les mécanismes régissant cette "guerre des sexes" moléculaire.
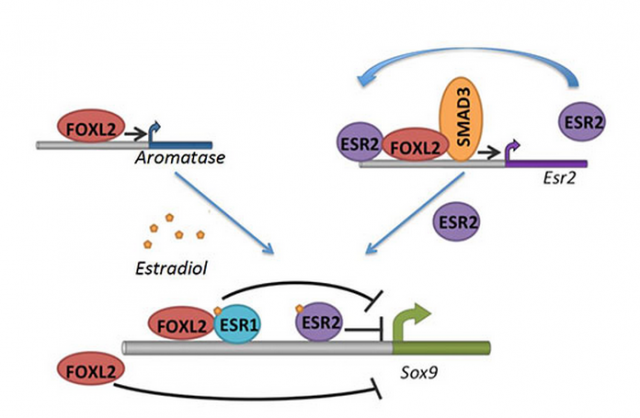
Figure: Bataille moléculaire orchestrée par FOXL2 pour maintenir l'identité de l'ovaire. FOXL2 stimule la production d'estradiol via l'activation directe du gène de l'aromatase (codant l'enzyme qui convertit les androgènes en estradiol). FOXL2 stimule aussi la production du récepteur beta de l'estradiol (ESR2). Ensemble, FOXL2 et les récepteurs alpha et beta (ESR1 et 2), activés par l'estradiol, réprimeront de manière directe et/ou indirecte l'expression de Sox9 dans l'ovaire et ainsi le "programme" testiculaire.
© Reiner Veitia
Afin d'étudier en détail le mécanisme d'action du facteur FOXL2 et de certains de ses partenaires, l'équipe de R. Veitia a cultivé des cellules de soutien de l'ovaire de souris pour identifier les séquences d'ADN sur lesquelles FOXL2 se lie et module ainsi l'expression de gènes importants pour le fonctionnement de l'ovaire. Cette approche a permis aux chercheurs de montrer que FOXL2 orchestre l'expression d'un réseau de gènes qui assure la production d'œstrogènes et contrôle de plus la production du récepteur de type beta à ces hormones. Une étude antérieure d'une autre équipe avait conclu que FOXL2 interagissait avec le récepteur aux œstrogènes de type alpha pour réprimer les gènes "mâles" tout au long de la vie de l'ovaire. L'étude de l'équipe de R. Veitia démontre que, dans les cellules de soutien matures, le récepteur alpha joue en fait un rôle mineur par rapport au récepteur de type beta qui prend le relais dans la répression des gènes mâles, sous le contrôle de FOXL2.
Un rôle particulièrement important de FOXL2 et des récepteurs aux œstrogènes dans les cellules de soutien est la répression du gène Sox9 indispensable pour que ces cellules conservent leur identité et ne se transforment pas en leurs homologues testiculaires. Cette étude montre que FOXL2 organise la répression de Sox9 par plusieurs canaux indépendants, dont l'un est la production de récepteurs aux œstrogènes de type beta et un autre celle des hormones qui l'activent.
Cette étude apporte de nouvelles données originales sur les fonctions de FOXL2 et de ses partenaires ouvrant ainsi la voie à des recherches approfondies qui permettront d'élucider plus complètement les mécanismes moléculaires et cellulaires du développement de l'ovaire et du maintien de son identité.
Pour plus d'information voir: The transcription factor FOXL2 mobilizes estrogen signaling to maintain the identity of ovarian granulosa cells.