Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
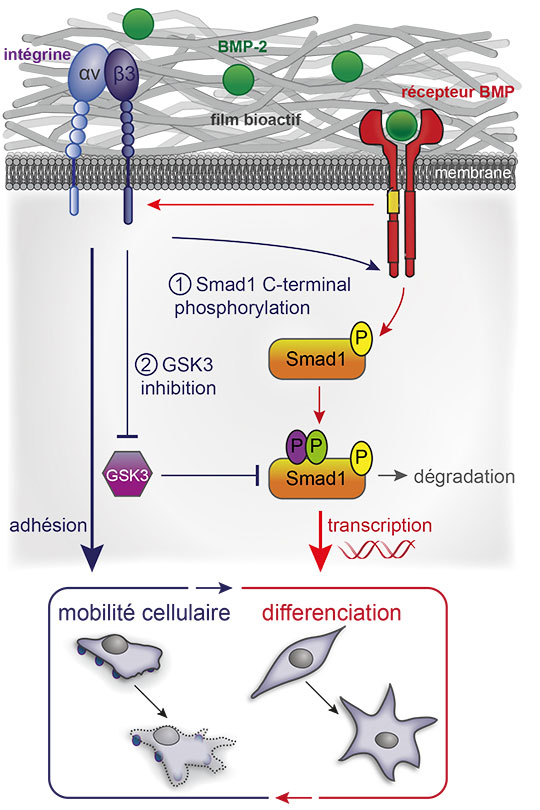
Figure: Convergence de la signalisation par un récepteur d'adhérence cellulaire (intégrine b3) et un récepteur de différenciation cellulaire (récepteur BPM) pour contrôler la différenciation osseuse après contact des cellules musculaires avec un biofilm chargé en BMP-2.
© Corinne Albiges-Rizo
Comprendre comment les cellules intègrent différents stimuli physico-chimiques et orientent les processus de différentiation reste une question importante en biologie cellulaire. La matrice extracellulaire est composée de protéines matricielles, de polysaccharides, de protéoglycanes tout en étant un réservoir de facteurs de croissance contrôlant leur distribution spatiale et leur bioactivité. Grâce à cette matrice, les cellules sont capables de percevoir les propriétés physico-chimiques de leur environnement et d'adapter leur forme, leur comportement migratoire, leur capacité à proliférer ou encore leur propre destinée. Il reste cependant difficile de discriminer l'impact d'un signal mécanique lié à rigidité de l'environnement cellulaire de celui d'un signal biochimique.
Les équipes de Corinne Albiges-Rizo à l'Institut Albert Bonniot et de Catherine Picart au laboratoire des Matériaux et du Génie Physique ont exploré les conséquences de la présentation physiologique d'un facteur de croissance BMP-2 (Bone Morphogenetic Protein 2) connu pour sa capacité à induire une différenciation osseuse et une régénération des os. Pour cela, les chercheurs ont mis à profit un biomatériau dont les propriétés mécaniques sont contrôlables et qui présente une forte affinité pour le facteur BMP-2, permettant ainsi de le localiser à la surface du biomatériau.
Les résultats montrent que le signal biochimique fourni par le BMP-2 lié au biomatériau est suffisant pour induire un étalement de cellules musculaires, qui est lui-même dépendant du récepteur d'adhésion (intégrine 3), en outrepassant le signal dû à la rigidité du biomatériau. L'organisation du cytosquelette d'actine et la dynamique des sites d'adhérence s'en trouvent impactées. En retour, l'intégrine 3 est indispensable pour activer le récepteur au BMP-2 (BMPR) et la voie de signalisation en aval associée (Smad) qui est cruciale pour la différenciation ostéogénique. L'intégrine b3 impacte la signalisation Smad en la contrôlant à deux niveaux: à la membrane cellulaire en contrôlant l'activité même du BMPR et plus en aval, en contrôlant une kinase inhibitrice de la voie Smad (appelée GSK3).
Ces travaux mettent en évidence l'action coordonnée entre deux récepteurs membranaires, le récepteur BMPR et l'intégrine b3, pour contrôler la signalisation Smad et l'homéostasie cellulaire. Ce travail a permis de décrypter les mécanismes moléculaires permettant le couplage et la coordination fonctionnelle entre l'adhérence cellulaire et l'engagement vers une différenciation cellulaire donnée, deux processus fondamentaux de la biologie du développement et de la médecine régénératrice.
Cette étude est le fruit d'un projet interdisciplinaire développé par Laure Fourel dans la perspective de comprendre les mécanismes de l'adaptation des cellules à leur environnement et optimiser les matériaux biomimétiques pour l'ingénierie des tissus osseux.