Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
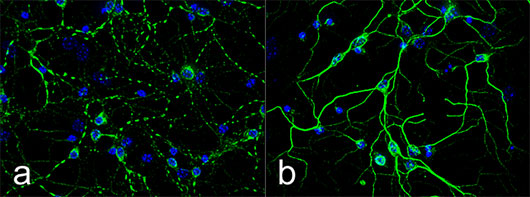
Figure 1: L'infection des neurones par les prions pathogènes entraine une perte de polarité neuronale caractérisée ici par la fragmentation des dendrites (a). L'inhibition pharmacologique de ROCK protège les neurones des altérations morphologiques induites par les prions (b). Immunomarquage des dendrites avec un anticorps dirigé contre la protéine MAP2.
© Aurélie Alleaume-Butaux et Benoit Schneider
Les maladies à prions (telle que la maladie de Creutzfeldt-Jakob et son variant chez l'homme, l'Encéphalopathie Spongiforme Bovine - ESB - ou maladie de la "vache folle" chez l'animal) sont caractérisées par l'accumulation dans le cerveau d'une protéine anormale, la protéine prion scrapie PrPSc. Cette protéine est toxique pour les neurones: elle provoque leur mort ce qui est à l'origine des principaux signes cliniques associés aux maladies à prions. Les mécanismes par lesquels la PrPSc exerce sa toxicité vis-à-vis des neurones demeurent toutefois énigmatiques.
Les travaux menés par les équipes de Benoit Schneider et Odile Kellermann (Unité Inserm 1124, équipe "Cellules Souches, Signalisation et Prions", Université Paris Descartes) et de Jean-Marie Launay (Unité Inserm 942, Hôpital Lariboisière) en collaboration avec d'autres équipes françaises impliquées dans l'étude des maladies à prions, identifient une enzyme, la kinase ROCK, dont la dérégulation contribue à la mort des neurones infectés par les prions.
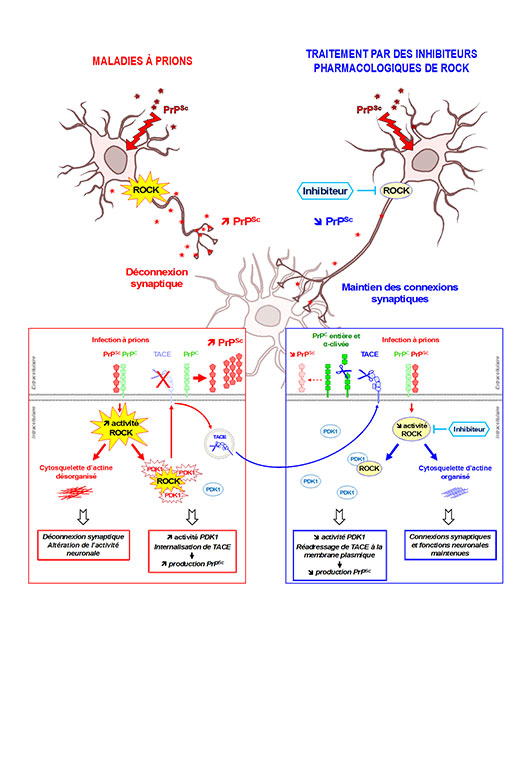
Figure 2:Dans les neurones infectés par les prions, la suractivation de la kinase ROCK exerce un double effet délétère (i) en désorganisant le cytosquelette d'actine à l'origine de la déconnexion synaptique et de l'altération de l'activité neuronale et (ii) en dérégulant l'axe PDK1-TACE. L'interaction ROCK-PDK1 suractive la kinase PDK1, qui à son tour provoque l'internalisation de l'?-sécrétase TACE et annule sa fonction de clivage protectrice. TACE ne clive plus la protéine prion cellulaire non pathologique PrPC favorisant la production et l'accumulation des prions pathogènes PrPSc. L'inhibition de ROCK permet de maintenir les connexions et les fonctions neuronales en rétablissant la dynamique du cytosquelette d'actine mais aussi d'atténuer l'activité PDK1, ce qui restaure l'activité protectrice de TACE et diminue ainsi la charge en PrPSc.
© Aurélie Alleaume-Butaux et Benoit Schneider
Les chercheurs dévoilent que l'infection des neurones par les prions pathogènes provoque une forte augmentation d'activité de la kinase ROCK. ROCK alors suractivée agit sur le squelette de la cellule, le cytosquelette d'actine, et le déstabilise entrainant une modification de l'architecture des neurones (Figure 1). Ces anomalies de structure provoquent la déconnexion synaptique des neurones infectés par les prions et la rétraction des axones, à l'origine d'une perturbation de l'activité neuronale (Figure 2).
De plus, la suractivation de ROCK dans les neurones infectés par les prions exerce un deuxième effet délétère via une autre kinase, PDK1, dont le rôle critique dans les maladies à prions et la maladie d'Alzheimer avait été mis en évidence par ces mêmes équipes en 2013. En interagissant avec PDK1, ROCK stimule l'activité PDK1 qui à son tour déclenche une cascade de réactions menant à la neutralisation d'une enzyme de protection, l'alpha-sécrétase TACE. TACE ne peut alors plus assumer son activité de clivage sur la protéine prion cellulaire non pathologique PrPC, favorisant alors la production et l'accumulation des prions pathogènes PrPSc (Figure 2).
Le blocage pharmacologique de ROCK exerce un double effet bénéfique dans les neurones infectés par les prions: (i) il préserve les connexions et les fonctions neuronales, et (ii) il atténue l'activité PDK1, ce qui rétablit le rôle protecteur de TACE en restaurant le clivage de la PrPC, et par conséquent réduit la charge en prions pathogènes (Figure 2).
La double action de ROCK sur la connectivité des neurones et l'axe PDK1-TACE a été mis en évidence in vitro après infection d'une lignée neuronale et de cultures de neurones issus du cerveau de souris, puis in vivo sur des modèles murins. Un traitement par deux inhibiteurs pharmacologiques distincts de ROCK permet d'atténuer les déficits moteurs et de prolonger la durée de vie des souris infectées par les prions, permettant ainsi d'identifier ROCK comme cible thérapeutique potentielle pour les maladies à prions.
"Il n'existe actuellement pas de traitement efficace pour lutter contre les maladies à prions. La découverte du rôle central de ROCK dans la progression de ces maladies neurodégénératives offrent alors de nouvelles perspectives thérapeutiques" concluent les chercheurs. A l'heure où un individu sur 2000 dans la population britannique est porteur sain de l'agent responsable de la maladie de la "vache folle" et où un cas d'ESB est très récemment réapparu dans le cheptel bovin en Irlande, pays jusqu'alors considéré comme "pays à risque négligeable", la découverte de ces nouveaux mécanismes de neurodégénérescence dans les maladies à prions tombe à point nommé.