Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Une équipe de chercheurs coordonnée par Jérôme Estaquier, de l'Unité Inserm 841 à l'Institut Mondor de Recherche Biomédicale (IMRB) de Créteil et de l'Unité CNRS de Physiopathologie des Infections Lentivirales à l'Institut Pasteur à Paris, vient d'apporter de nouveaux éléments de réponse dans une étude publiée par la revue Cell Death and Differentiation. En étudiant des modèles animaux, ils ont montré que les ganglions lymphatiques de la région intestinale étaient les principaux réservoirs du VIH et que le virus persistait même chez les individus infectés depuis plus de 10 ans avec une charge virale pourtant indétectable. Ils ont également découvert que les lymphocytes T CD8 ne jouaient pas leur rôle dans le contrôle du réservoir en raison d'un défaut de survie. Ces travaux fournissent ainsi de nouvelles clés quant aux stratégies susceptibles d'être mises en œuvre pour combattre le VIH.
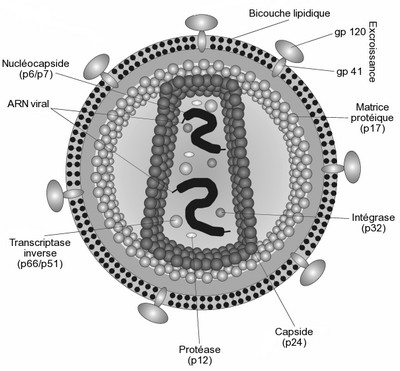
Coupe schématique du virus de l'immunodéficience humaine (VIH)
Depuis de nombreuses années, il a été observé que, après l'arrêt des thérapies hautement actives (HAART) chez les patients infectés par le virus de l'immunodéficience humaine (VIH), le virus réapparaissait très rapidement. Cette réémergence indiquait l'existence d'un réservoir viral "profond" persistant même après de nombreuses années de traitement. Ce réservoir viral représente donc une barrière majeure à l'éradication du virus, en permettant une réalimentation rapide de l'organisme en virus circulants après l'arrêt de traitement. Ces observations suggéraient également que la réponse immunitaire était incapable de contrôler ce réservoir du VIH.
Les ganglions mésentériques, principaux réservoirs du VIH
Jérôme Estaquier et ses collaborateurs de l'Inserm, du CNRS et de l'Institut Pasteur se sont donc intéressés à cette obscure question du réservoir viral du VIH. En analysant différents compartiments lymphoïdes et non lymphoïdes de modèles animaux, ils ont montré que les ganglions lymphatiques drainant la région intestinale (ganglions mésentériques) étaient les principaux réservoirs du virus, y compris chez des individus n'ayant pas de virus détectables dans le sang ou dans les ganglions périphériques après plus de dix ans d'infection.
Ces chercheurs ont également montré que les lymphocytes T CD8 cytotoxiques des ganglions mésentériques avaient une propension plus importante à mourir. Ces "lymphocytes tueurs" sont habituellement capables de contrôler le virus, en détruisant les cellules infectées. Le défaut de survie de ces lymphocytes autorise donc la dissémination du virus des ganglions mésentériques vers les autres organes, induisant ainsi la progression vers le stade sida.
Par ailleurs, les chercheurs ont identifié dans les organes lymphoïdes la molécule qui pourrait être responsable de cette anomalie des lymphocytes T CD8. Il s'agit du TGF-bêta, une cytokine immunosuppressive (1) est également impliquée dans d'autres pathologies comme le cancer.
Développer de nouvelles stratégies thérapeutiques
Ces travaux apportent des éléments essentiels qui devraient permettre de tester de nouvelles stratégies pour combattre l'infection par le VIH. Des stratégies visant à inhiber les fonctions immunosuppressives du TGF-bêta ou restaurer la survie des cellules T CD8 devraient permettre de mieux contrôler le virus. Enfin, des thérapies ciblant plus spécifiquement les ganglions mésentériques pourraient conduire à un meilleur contrôle de la dissémination du virus. Les recherches futures viseront donc à tester in vivo l'impact de telles approches.
(1) Substance soluble de communication cellulaire synthétisée par les cellules macrophages, inhibant à courte distance l'activité et la fonction des lymphocytes T CD8 et entraînant leur mort prématurée.