Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
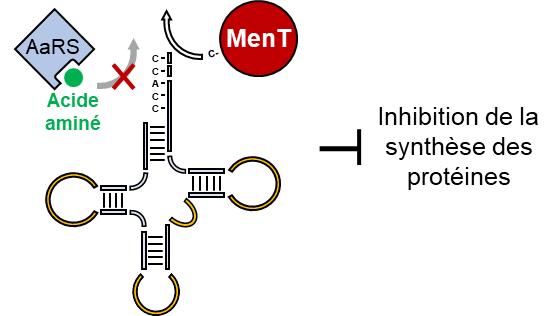
Mécanisme d'inhibition de la traduction par la toxine MenT: L'élongation par MenT au niveau de l'extrémité 3'-CCA bloque l'aminoacylation de l'ARN de transfert, inhibant ainsi la traduction et la croissance bactérienne (AaRS: aminoacyl-ARNt synthétase).
© Pierre Genevaux
Les systèmes dits "toxine-antitoxine" (TA) sont très largement représentés au sein des génomes bactériens. Ils sont composés d'une toxine capable de bloquer la croissance bactérienne, et d'une antitoxine qui inhibe l'action de la toxine dans des conditions normales de croissance. Bien que leurs fonctions physiologiques restent mal comprises, il a été suggéré que l'activation de toxines de systèmes TA pourrait permettre aux bactéries de résister à certaines conditions de stress, comme les traitements antibiotiques ou la réponse immunitaire lors d'une infection, en freinant leur croissance.
Il a été également suggéré que certaines toxines pourraient conduire à la mort des bactéries, sous forme de "mort altruiste", lors d'une attaque par des bactériophages, des virus qui infectent les bactéries. Les propriétés antibactériennes remarquables de certaines toxines bactériennes, ainsi que leurs cibles au sein des bactéries, en font des protéines d'intérêt thérapeutique très pertinentes.
La virulence du bacille de la tuberculose, Mycobacterium tuberculosis, repose largement sur sa capacité à s'adapter aux nombreux stress qu'il rencontre au cours de son cycle infectieux, notamment en entrant dans un état dit de "persistance" lui permettant de survivre jusqu'à ce que les conditions deviennent plus favorables à son développement, comme lors de l'affaiblissement du système immunitaire de son hôte. M. tuberculosis a la particularité de posséder un nombre très important de systèmes TA (plus de 80), qui pourraient participer à l'établissement de la phase de persistance chez cette bactérie.
Les travaux, menés en collaboration avec l'Université de Durham, ont permis d'identifier une nouvelle toxine, appelée MenT, qui, lorsqu'elle n'est pas neutralisée par son antitoxine MenA, bloque rapidement la croissance M. tuberculosis, conduisant même jusqu'à la mort du bacille quand elle est produite en trop grande quantité. Les chercheurs ont obtenu la structure tridimensionnelle de MenT à une très haute résolution (1,23 Å), et des analyses génétiques et biochimiques ont montré que cette toxine inhibe la synthèse des protéines par un mécanisme entièrement nouveau, impliquant l'inhibition de l'aminoacylation des ARN de transfert.
Les ARN de transfert sont de petits acides nucléiques qui permettent de synthétiser les protéines en enchainant les acides aminés qui les constituent. Pour être fonctionnels, les ARN de transfert doivent au préalable être chargés en acides aminés (réaction d'aminoacylation), chaque ARN de transfert étant spécifique d'un acide aminé qu'il apporte dans la protéine en cours de synthèse. Les chercheurs ont montré que la toxine MenT rend impossible le chargement des ARN de transfert, en particulier ceux qui portent l'acide aminé sérine, en modifiant l'extrémité acceptrice de l'ARNt.
Ainsi, cette étude identifie un mécanisme jusqu'alors inconnu qui élargit la gamme des activités enzymatiques employées par les toxines bactériennes, découvrant ainsi une nouvelle façon de bloquer la synthèse des protéines et de traiter potentiellement la tuberculose et d'autres infections. En effet, l'activation forcée de MenT, ou la déstabilisation des complexes inactifs entre MenT et son antitoxine MenA, par des petits composés devraient conduire à la mort du bacille, ce qui laisse envisager de nombreuses pistes pour la recherche de nouveaux médicaments pour lutter contre la tuberculose, maladie infectieuse qui reste encore aujourd'hui la plus meurtrière, avec près de 1,5 millions de décès chaque année dans le monde.
Pour en savoir plus:
A nucleotidyltransferase toxin inhibits growth of Mycobacterium tuberculosis through inactivation of tRNA acceptor stems
CaiY, UsherB, Gutierrez C, Tolcan A, Mansour M, Fineran PC, Condon C, Neyrolles O, GenevauxP, BlowerTR.
Science Advances, 29 July 2020. DOI: 10.1126/sciadv.abb6651.
Laboratoire:
Laboratoire de microbiologie et génétique moléculaires - Centre de biologie intégrative (CBI) - (CNRS/Université Paul-Sabatier)
118, route de Narbonne.
31062 Toulouse cedex 09-France.