Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
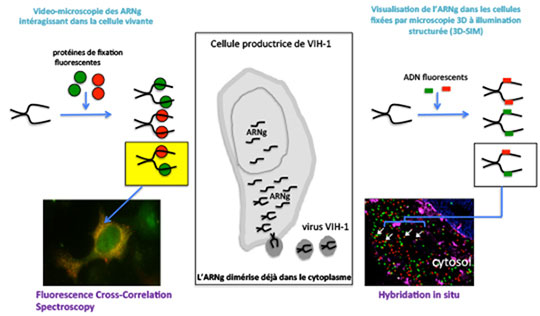
Figure 1: Visualisation 3D de l'orchestration subcellulaire de la dimérisation du génome ARN (ARNg) du VIH-1 dans les cellules par microscopie à super résolution, à l'échelle de la molécule d'ARN unique. Pendant le cycle de réplication du virus dans la cellule hôte, le rétrovirus doit sélectionner son génome ARN (ARNg) dans la cellule et encapsider spécifiquement 2 copies identiques d'ARNg afin de libérer un virus infectieux (au centre). Ce processus est observé grâce à deux approches complémentaires de super résolution pour la détection d'ARN: à gauche, l'utilisation de protéines fluorescentes de deux couleurs fixant l'ARNg avec une forte affinité permet de suivre l'ARNg devenu fluorescent dans les cellules vivantes et les dimères jaunes; à droite, la cellule hôte est perméabilisée afin d'y faire entrer des fragments d'ADN fluorescents de deux couleurs, qui vont spécifiquement fixer l'ARNg et le rendre fluorescent. La microscopie 3D-SIM permet d'avoir 100 images/seconde avec une résolution spatiale d'environ 150 nm (8 fois plus qu'un microscope confocal).
© Oxford University Press. Marylène Mougel.
Le virus de l'immunodéficience humaine, VIH-1, comme la plupart des rétrovirus, présente la caractéristique unique d'avoir un génome composé de deux molécules identiques d'ARNg. Les deux brins d'ARNg sont liés de façon non-covalente par de courtes séquences, on parle alors d'ARNg dimérique. Cette duplication du génome sécurise la sauvegarde de l'information génétique en cas d'endommagement d'un brin d'ARN, mais aussi apporte un avantage évolutif. En effet, lors de l'infection de la cellule, la copie en ADN du dimère ARNg par la transcriptase inverse est source d'erreurs, générant une diversité génétique qui constitue une force motrice majeure d'évolution et d'adaptation du VIH-1. La dimérisation est un moyen d'encapsider spécifiquement 2 copies ARNg lors de la formation du virus à la surface de la cellule et ainsi de libérer des virus infectieux contenant chacun 2 copies d'ARNg.
Comment, où et quand a lieu la dimérisation dans la cellule sont des questions qui n'ont pu être résolues par des approches classiques. Jusqu'à maintenant, le processus de dimérisation avait été étudié in vitro à l'aide d'ARN synthétiques ou au sein de particules virales, mais n'avait pas pu être analysé dans les différents compartiments de la cellule, faute de moyen suffisamment sensible pour suivre la minorité d'ARNg dimériques parmi l'immense population d'ARN cellulaires. Ce défi technologique a été relevé par l'équipe de Marylène Mougel au Centre d'études d'agents pathogènes et Biotechnologies pour la santé qui a réussi à visualiser, pour la première fois, la dimérisation d'ARNg dans le cytoplasme et à la surface de la cellule. Pour ce faire, les chercheurs ont utilisé deux approches de visualisation d'ARN à l'échelle de la molécule unique, combinées à deux stratégies de microscopie de fluorescence à super-résolution telles que la microscopie 3D à illumination structurée et la fluctuation de fluorescence.
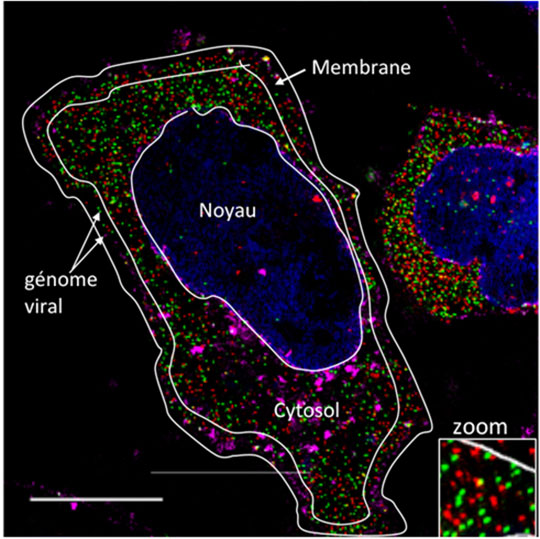
Figure 2: Visualisation en super-résolution des dimères d'ARN génomique du VIH-1 dans la cellule en utilisant la microscopie 3D à illumination structurée (3D-SIM).
© Oxford University Press. Marylène Mougel.
La performance de ces approches a permis de discriminer entre les interactions aléatoires entre ARNg et les ARNg interagissant spécifiquement pour former un dimère. De plus, les chercheurs ont pu filmer l'interaction spécifique des ARNg en temps réel dans le cytoplasme des cellules vivantes. Cette stratégie a permis d'étudier l'orchestration tridimensionnelle de la dimérisation des ARNg dans différents compartiments de la cellule humaine. Les chercheurs ont alors découvert la présence de dimères dans le cytoplasme, à la surface et pas dans le noyau de la cellule. Ces résultats indiquent que la dimérisation s'initie déjà dans le cytoplasme et que les ARNg sont acheminés à la surface déjà sous la forme dimérique, une observation très surprenante au vu de la forte dilution des ARNg dans ce comportement, ouvrant le risque à des erreurs d'appariements avec d'autres ARN beaucoup plus abondants. Ces résultats modifient clairement l'hypothèse généralement admise que les ARNg dimérisent lors de leur accumulation à la surface cellulaire pour l'assemblage et la formation de la particule virale. Cette nouvelle notion ouvre de nouvelles perspectives dans les mécanismes de sélection et d'encapsidation des ARN dans les virus.
Les méthodologies innovantes développées ici ouvrent la voie à de nombreuses applications. La possibilité de détecter spécifiquement des molécules uniques d'ARN en mouvement et en interaction dans une cellule humaine et dans les virus produits laisse entrevoir des applications dans le développement d'inhibiteurs antiviraux bloquant l'encapsidation du génome du VIH-1, dans le développement de stratégie de délivrance de gènes par des vecteurs viraux à des fins de thérapie génique et dans le domaine plus général de l'étude du transport intracellulaire des ARN cellulaires.