Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
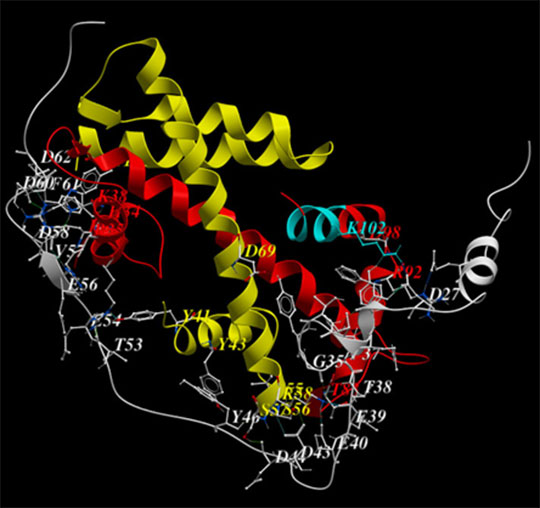
Figure: Structure cristallographique de la protéine YL1 humaine (colorée en gris) en interaction avec la paire d'histone H2A.Z/H2B (rouge/jaune). La liaison de YL1 à H2A.Z entraine une extension (colorée en bleu) de l'hélice ?C de H2A.Z qui double de taille.
© Christophe Romier. Ali Hamiche
L'accès à l'ADN dans les cellules est étroitement contrôlé pour permettre l'expression ou l'extinction des gènes. Ce processus d'activation ou d'inactivation est essentiel au maintien du contrôle de l'expression génique au cours du développement. En effet, différents ensembles de gènes peuvent être activés ou inactivés en fonction du destin cellulaire; par exemple pour permettre à une cellule musculaire de se comporter différemment d'une cellule nerveuse. La régulation des gènes joue également un rôle important dans l'adaptation aux changements environnementaux. Bien que la régulation génique soit essentielle à la vie, ce processus complexe est encore mal compris.
La régulation des gènes est intimement liée à l'organisation et à la fonction de la chromatine. Cette dernière est une structure fondamentale localisée dans le noyau cellulaire. Elle est constituée d'ADN enroulé autour de nucléosomes. Quatre protéines basiques appelées histones (H2A, H2B, H3 et H4) forment le coeur du nucléosome et sont responsables de la liaison à l'ADN. Parmi les mécanismes épigénétiques, qui permettent de modifier la structure et la composition de la chromatine, le remplacement des histones canoniques par des variantes d'histones pour marquer des régions spécifiques du génome joue un rôle important dans la régulation de l'expression des gènes. La variante d'histone H2A.Z se localise au niveau des promoteurs de nombreux gènes pour réguler leur expression. Cependant, la façon dont H2A.Z est déposée et enlevée des promoteurs des gènes, est encore mal comprise.
L'équipe d'Ali Hamiche a utilisé une approche biochimique pour décrypter le rôle précis de H2A.Z dans l'activation ou l'inactivation des gènes. Les chercheurs ont identifié la protéine YL1 comme une chaperonne spécifique de H2A.Z responsable de sa déposition sur la chromatine. En collaboration avec l'équipe de Christophe Romier, ils ont résolu la structure cristallographique de YL1 en association avec le dimère H2A.Z/H2B. Ils ont ensuite démontré par une analyse mutationnelle comment YL1 se lie spécifiquement à H2A.Z. Grâce à la combinaison des analyses biochimiques et structurales, les chercheurs ont établi que YL1 induit un changement important dans la structure de H2A.Z. Cependant, contrairement à d'autres chaperonnes de l'histone H2A.Z caractérisées précédemment par ces mêmes équipes, telle que ANP32E, YL1 interagit avec H2A.Z à travers une surface beaucoup plus étendue.
Cette étude va considérablement élargir notre compréhension du mécanisme de déposition de H2A.Z sur la chromatine. Elle ouvre également la voie pour élucider comment des dérégulations des mécanismes de déposition ou éviction de l'histone variante H2A.Z peuvent conduire à la tumorigenèse. Ces connaissances devraient également permettre de développer de nouvelles approches thérapeutiques ciblant ces mécanismes afin de lutter contre le cancer.