
Bei einer experimentellen Infektion mit GAS tritt in vivo ein Mutant auf, der jedoch eine abgeschwächte Virulenz aufweist. In einem Artikel, der in Nature Communications veröffentlicht wurde, erklären Wissenschaftler die Gründe für das paradoxe Auftreten dieses Mutanten, der den Membrangehalt beeinflusst, und die Implikationen dieser Entdeckung für die Identifizierung neuer therapeutischer Ziele.
Der Regulator des Fettsäurebiosynthesewegs bei Streptokokken und seine Rolle bei der Infektion
Die Lipidmembran ist zentral für alle zellulären Transaktionen. Viele Bakterien synthetisieren Fettsäuren, Vorläufer der Lipide, die wesentliche Bestandteile der Membranen sind, über den Syntheseweg, der als FASII bezeichnet wird. Beim gefürchteten Pathogen Streptococcus pyogenes, oder Gruppe-A-Streptokokken (GAS), das weltweit für mehr als 517.000 Todesfälle pro Jahr verantwortlich ist, basiert die Expression der Gene dieses Weges auf der Aktivität eines Proteins, das als FabT bezeichnet wird und sich an DNA bindet, um die Expression der FASII-Gene zu unterdrücken.
Die Wissenschaftler untersuchten die Rolle von FabT während der GAS-Infektion. Die Forscher waren von einem Paradoxon fasziniert: Obwohl FabT-Defekte in Tiermodellen mit einer verminderten Virulenz einhergehen, treten in vivo spontane Mutationen von FabT auf.
Die Ambivalenz zwischen dem für die Infektion notwendigen FabT-Repressor und dem Auftreten von fabT-Mutanten
FabT wirkt als Repressor von FASII, was zu einer Aufnahme von exogenen Fettsäuren (eFAs) anstelle ihrer eigenen Synthese führt. Mutierte Stämme von FabT haben das Signal verloren, das die Fettsäuresynthese stoppt, auch wenn eFAs verfügbar sind. Infolgedessen produzieren sie längere Fettsäuren, was zu Membrandefekten führt. Darüber hinaus führt diese Synthese zu einem höheren Nährstoffbedarf und damit zu einem höheren Energieverbrauch, ohne dass das bakterielle Wachstum ermöglicht wird. Diese beiden Defizite führen schließlich zum Tod der Bakterien.
Der Mutant kann sich weder ex vivo auf menschlichem Gewebe noch auf Zellen oder in zellulären und gewebeartigen Filtraten entwickeln – alles Situationen, in denen Nährstoffe begrenzt sind. Diese Merkmale erklären die Notwendigkeit von FabT während der Infektion. Im Gegensatz dazu weisen fabT-Mutanten ein ausgeprägtes Wachstumsvorteil gegenüber dem Wildtyp auf, wenn sie gesättigten eFAs ausgesetzt sind, die beispielsweise im Interstitialraum vorkommen. Tatsächlich sind diese gesättigten Fettsäuren nach ihrer Aufnahme durch den Wildtyp toxisch.
Die Forscher haben gezeigt, dass die kontinuierliche Aktivität von FASII, wie sie im fabT-Mutanten vorkommt, diese Aufnahme verhindert. Außerdem wurden spontane fabT-Mutanten in vitro durch Kultivierung des Wildtyps in Anwesenheit von gesättigten eFAs erhalten. Darüber hinaus zeigte ein ex vivo-Muskelmodell, das reich an gesättigten Fettsäuren ist, dass der fabT-Mutant einen ausgeprägten Wachstumsvorteil gegenüber dem Wildtyp besitzt. Tatsächlich hängt das Überleben sowohl des fabT-Mutanten als auch des wilden GAS von der Lokalisierung des Bakteriums ab.
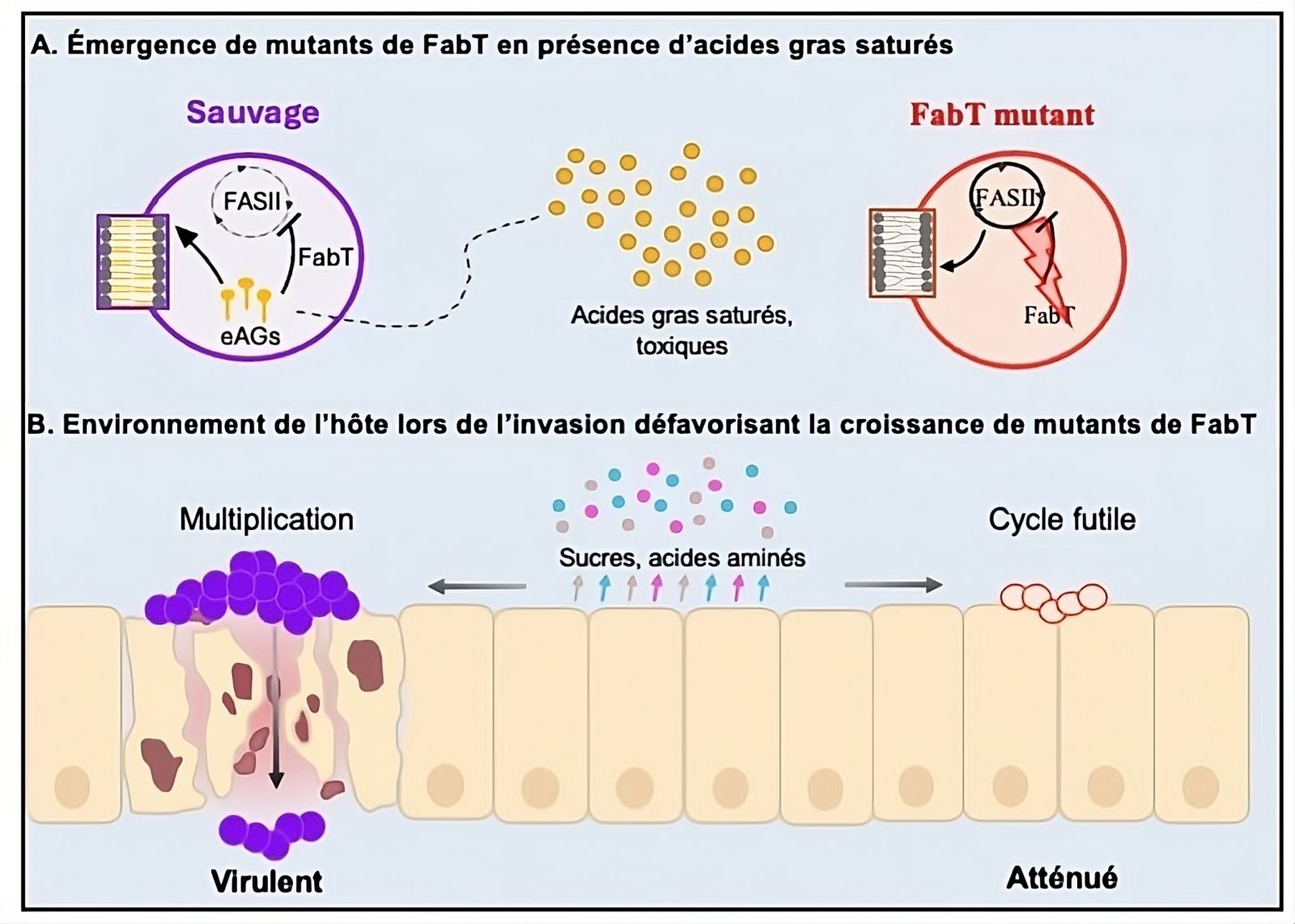
Modell für das Auftreten von fabT-Mutanten mit abgeschwächter Virulenz
A: Gesättigte Fettsäuren begünstigen das Auftreten von fabT-Mutanten, die gegen ihre Toxizität resistent sind, wenn sie mit dem Wirt in Kontakt kommen.
B: Die fabT-Mutanten unterliegen in einem nährstoffarmen Umfeld einem metabolischen Stress, der ihr Bakterienwachstum während der Infektion einschränkt.
© Clara Lambert, Paprapach Wongdontree, Alexandra Gruss, Agnès Fouet
Diese Ergebnisse erklären den Grund für das Auftreten von fabT-Mutanten, die das Überleben in Lipid-reichen Biotopen, die aus gesättigten Fettsäuren bestehen, verbessern, jedoch zu einer genetischen Sackgasse für die Infektion führen.
Diese Forscherteams hatten zuvor gezeigt, dass die Hemmung des FASII-Wegs aufgrund der in vivo Aufnahme von eFAs durch verschiedene grampositive Bakterienarten keine therapeutische Option darstellt. Die vorliegende Studie zeigt jedoch, dass es im Gegenteil nachteilig ist, die FASII-Synthese durch Hemmung von FabT dauerhaft zu machen, was der Infektion in vivo schadet. FabT stellt somit ein potenzielles therapeutisches Ziel für neue Therapien gegen spezifische grampositive Pathogene dar, darunter GAS, Streptococcus agalactiae, Streptococcus pneumoniae und Enterococcus faecalis.
Quelle:
Die Doppelrolle des FASII-Regulators FabT bei der Streptococcus pyogenes-Infektion. Lambert C, Gaillard M, Wongdontree P, Bachmann C, Hautcoeur A, Gloux K, Guilbert T, Méhats C, Prost B, Solgadi A, Abreu S, Andrieu M, Poyart C, Gruss A* und Fouet A*.
4. Oktober 2024, Nature Communication, DOI: 10.1038/s41467-024-52637-3