
Durante uma infecção experimental por SGA, um mutante aparece in vivo que, no entanto, apresenta uma virulência atenuada. Em um artigo publicado na Nature communications, os cientistas explicam as razões que levam ao aparecimento paradoxal desse mutante, que afeta o conteúdo da membrana, e as implicações dessa descoberta para a identificação de novos alvos terapêuticos.
O regulador da via de biossíntese dos ácidos graxos em estreptococos e seu papel na infecção
A membrana lipídica é central para todas as transações celulares. Muitas bactérias sintetizam ácidos graxos, precursores dos lipídios, componentes essenciais das membranas, via a via de síntese chamada FASII. No temível patógeno Streptococcus pyogenes, ou Estreptococo do Grupo A (SGA), responsável por mais de 517.000 mortes por ano no mundo, a expressão dos genes dessa via depende da atividade de uma proteína chamada FabT, que se liga ao DNA e reprime a expressão dos genes FASII.
Os cientistas se interessaram pelo papel de FabT durante a infecção por SGA. Os cientistas ficaram intrigados por um paradoxo: embora as falhas de FabT estejam relacionadas a uma virulência atenuada em modelos animais, mutantes espontâneos de FabT aparecem in vivo.
A ambivalência entre FabT repressor necessário para a infecção e o surgimento de mutantes fabT
FabT atua como um repressor da FASII, o que resulta na incorporação de ácidos graxos exógenos (eAGs) em substituição à sua síntese. As cepas mutadas para FabT perderam o sinal que interrompe a síntese de AGs, mesmo quando eAGs estão disponíveis. Consequentemente, elas produzem AGs mais longos, levando a defeitos na membrana. Além disso, essa síntese induz um maior consumo de nutrientes, e, portanto, uma dissipação de energia elevada, sem permitir o crescimento bacteriano. Esses dois defeitos levam à morte bacteriana.
De fato, o mutante não consegue se desenvolver ex vivo em tecido humano, nem em células ou filtrados celulares e teciduais, todas situações em que os nutrientes são limitados. Essas características explicam a necessidade de FabT durante a infecção. Inversamente, os mutantes fabT apresentam uma vantagem de crescimento em relação à cepa selvagem quando expostos a eAGs saturados, presentes, por exemplo, em espaços intersticiais. De fato, os AGs saturados são tóxicos devido à sua incorporação pela cepa selvagem.
Os cientistas mostraram que a atividade contínua de FASII, como ocorre no mutante fabT, impede essa incorporação. Além disso, mutantes espontâneos de fabT foram obtidos in vitro durante o cultivo da cepa selvagem na presença de eAGs saturados. Além disso, um modelo ex vivo de músculo, que é rico em AGs saturados, revelou que o mutante fabT apresenta uma vantagem de crescimento marcada em comparação com a cepa selvagem. De fato, a sobrevivência do mutante fabT ou de SGA selvagem depende da localização da bactéria.
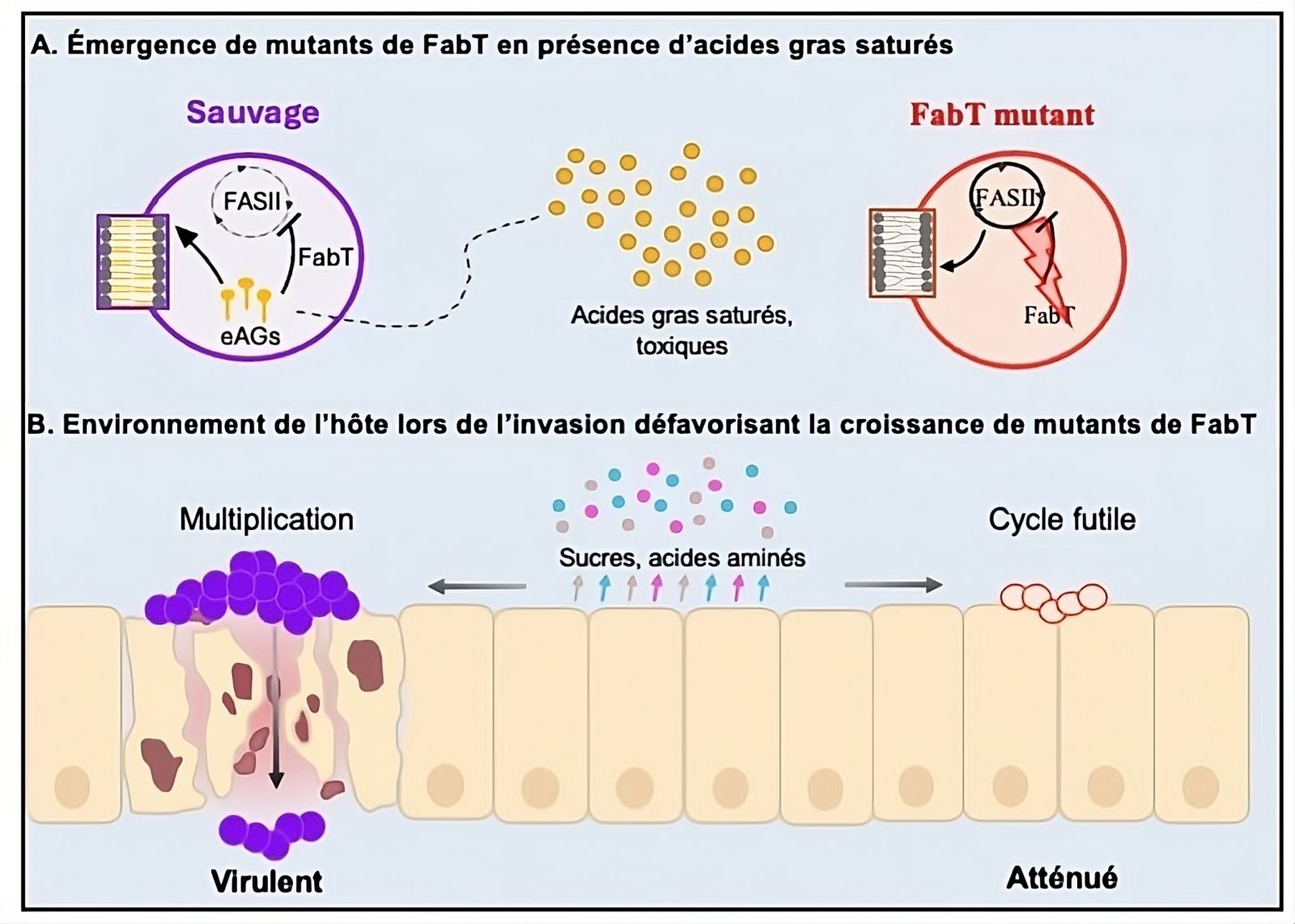
Modelo de emergência de mutantes fabT cuja virulência é atenuada
A: Os ácidos graxos saturados favorecem a emergência de mutantes fabT, resistentes à sua toxicidade durante o contato inicial com o hospedeiro.
B: Os mutantes fabT sofrem um estresse metabólico em ambiente pobre em nutrientes, limitando seu crescimento bacteriano durante a infecção.
© Clara Lambert, Paprapach Wongdontree, Alexandra Gruss, Agnès Fouet
Esses resultados elucidam a razão de ser dos mutantes fabT emergentes que melhoram a sobrevivência em biótopos ricos em lipídios compostos por AGs saturados, mas resultam em um beco genético para a infecção.
Essas equipes já haviam demonstrado anteriormente que inibir a via FASII não era uma opção terapêutica devido à incorporação de eAG in vivo por várias espécies de bactérias Gram-positivas. O presente estudo indica que, ao contrário, tornar a síntese da FASII constitutiva, inibindo FabT, prejudica a infecção in vivo. FabT é, portanto, um potencial alvo terapêutico para novos tratamentos contra patógenos Gram-positivos específicos, incluindo SGA, Streptococcus agalactiae, Streptococcus pneumoniae e Enterococcus faecalis.
Referência:
The double-edged role of FASII regulator FabT in Streptococcus pyogenes infection. Lambert C, Gaillard M, Wongdontree P, Bachmann C, Hautcoeur A, Gloux K, Guilbert T, Méhats C, Prost B, Solgadi A, Abreu S, Andrieu M, Poyart C, Gruss A* and Fouet A*.
4 outubro 2024, Nature Communication, DOI: 10.1038/s41467-024-52637-3