
Durante una infección experimental por EGA, aparece in vivo un mutante que, sin embargo, presenta una virulencia atenuada. En un artículo publicado en Nature Communications, los científicos explican las razones que provocan esta paradójica aparición de un mutante que afecta al contenido de la membrana, y las implicaciones de este descubrimiento para la identificación de nuevos objetivos terapéuticos.
El regulador de la vía de biosíntesis de los ácidos grasos en los estreptococos y su papel en la infección
La membrana lipídica es clave en todas las transacciones celulares. Numerosas bacterias sintetizan ácidos grasos, precursores de los lípidos, componentes esenciales de las membranas, via la vía de síntesis llamada FASII. En el temible patógeno Streptococcus pyogenes, o Estreptococo del Grupo A (EGA), responsable de más de 517 000 muertes anuales en todo el mundo, la expresión de los genes de esta vía depende de la actividad de una proteína llamada FabT, que se fija en el ADN y reprime la expresión de los genes FASII.
Los científicos se interesaron en el papel de FabT durante la infección por EGA. Se vieron intrigados por una paradoja: aunque los defectos en FabT se asocian a una virulencia atenuada en modelos animales, mutantes espontáneos de FabT emergen in vivo.
La ambivalencia entre FabT como represor necesario para la infección y la aparición de mutantes fabT
FabT actúa como un represor de FASII, lo que se traduce en una incorporación de ácidos grasos exógenos (AGE) en reemplazo de su síntesis. Las cepas mutantes para FabT han perdido la señal que detiene la síntesis de AG, incluso cuando los AGE están disponibles. Como resultado, producen AG más largos, lo que provoca defectos en la membrana. Además, esta síntesis induce un mayor consumo de nutrientes, provocando un mayor desperdicio de energía, sin permitir el crecimiento bacteriano. Estos dos defectos conducen a la muerte bacteriana.
De hecho, el mutante no logra desarrollarse ex vivo en tejido humano, ni en células o en filtrados celulares y tisulares, situaciones donde los nutrientes son limitados. Estas características explican la necesidad de FabT durante la infección. A la inversa, los mutantes fabT muestran una ventaja de crecimiento con respecto a la cepa salvaje cuando están expuestos a AGE saturados, presentes, por ejemplo, en espacios intersticiales. En efecto, los AG saturados son tóxicos tras su incorporación por la cepa salvaje.
Los científicos demostraron que la actividad continua de FASII, como en el mutante fabT, impide esta incorporación. Además, se obtuvieron mutantes espontáneos de fabT in vitro durante el cultivo de la cepa salvaje en presencia de AGE saturados. Además, un modelo de músculo ex vivo, que es rico en AG saturados, reveló que el mutante fabT tiene una ventaja de crecimiento marcada en comparación con la cepa salvaje. De hecho, la supervivencia del mutante fabT, o del EGA salvaje, depende de la localización de la bacteria.
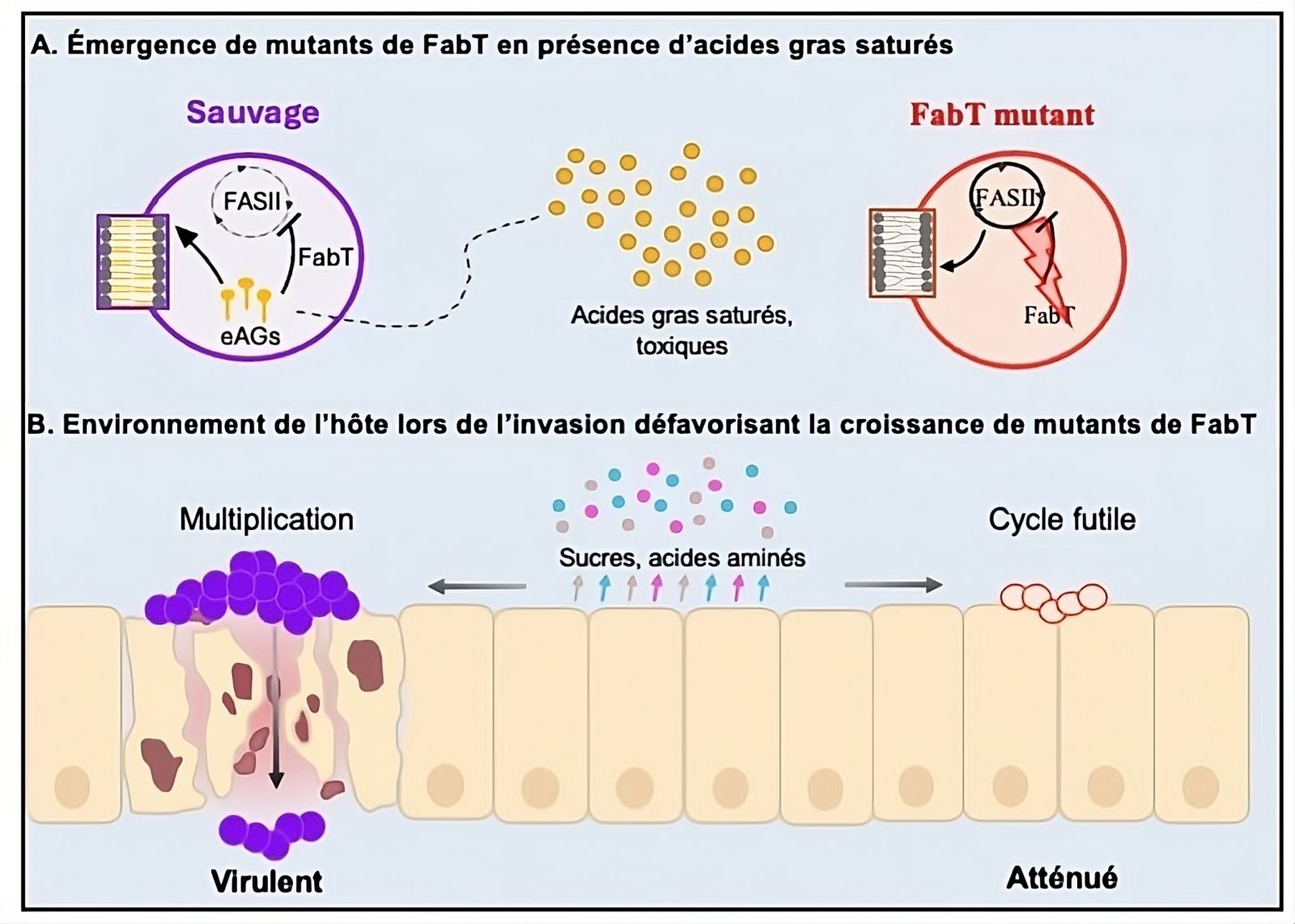
Modelo de emergencia de mutantes fabT cuya virulencia está atenuada
A: Los ácidos grasos saturados favorecen la aparición de mutantes fabT, que son resistentes a su toxicidad en el contacto inicial con el huésped.
B: Los mutantes fabT sufren estrés metabólico en ambientes pobres en nutrientes, limitando su crecimiento bacteriano durante la infección.
© Clara Lambert, Paprapach Wongdontree, Alexandra Gruss, Agnès Fouet
Estos resultados elucidan la razón de ser de los mutantes emergentes fabT, que mejoran la supervivencia en biotopos ricos en lípidos compuestos por AG saturados, pero conducen a un callejón sin salida genético durante la infección.
Estos equipos habían demostrado previamente que inhibir la vía FASII no era una opción terapéutica debido a la incorporación de AGE in vivo por diferentes especies bacterianas Gram-positivas. El presente estudio indica que, por el contrario, hacer que la síntesis de FASII sea constitutiva al inhibir FabT es perjudicial para la infección in vivo. Por lo tanto, FabT es un posible objetivo terapéutico para nuevas terapias contra patógenos Gram-positivos específicos, incluidos EGA, Streptococcus agalactiae, Streptococcus pneumoniae y Enterococcus faecalis.
Referencia:
The double-edged role of FASII regulator FabT in Streptococcus pyogenes infection. Lambert C, Gaillard M, Wongdontree P, Bachmann C, Hautcoeur A, Gloux K, Guilbert T, Méhats C, Prost B, Solgadi A, Abreu S, Andrieu M, Poyart C, Gruss A* y Fouet A*.
4 de octubre de 2024, Nature Communication, DOI: 10.1038/s41467-024-52637-3