Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

Lors d'une infection expérimentale par SGA, un mutant apparait in vivo qui présente pourtant une virulence atténuée. Dans un article publié dans Nature communications, des scientifiques expliquent les raisons qui poussent à l'apparition paradoxale de ce mutant qui affecte le contenu membranaire, et les implications de cette découverte pour l'identification de nouvelles cibles thérapeutiques.
Le régulateur de la voie de biosynthèse des acides gras chez les streptocoques et son rôle dans l'infection
La membrane lipidique est centrale pour toutes transactions cellulaires. De nombreuses bactéries synthétisent des acides gras, précurseurs des lipides, composants essentiels des membranes, via la voie de synthèse appelée FASII. Chez le redoutable pathogène Streptococcus pyogenes, ou Streptocoque du Groupe A (SGA), responsable de plus de 517 000 décès par an dans le monde, l'expression des gènes de cette voie repose sur l'activité d'une protéine, appelée FabT qui va se fixer sur l'ADN et réprimer l'expression des gènes FASII.
Les scientifiques se sont intéressés au rôle de FabT durant l'infection à SGA. Les scientifiques ont été intrigués par un paradoxe: bien que les défauts de FabT soient liés à une virulence atténuée dans les modèles animaux, des mutants spontanés de FabT apparaissent in vivo.
L'ambivalence entre FabT répresseur nécessaire à l'infection et émergence de mutants fabT
FabT agit comme un répresseur de FASII ce qui se traduit par une incorporation d'acides gras exogènes (eAGs) en remplacement de leur synthèse. Les souches mutées pour FabT ont perdu le signal qui arrête la synthèse d'AG, même lorsque des eAGs sont disponibles. En conséquence, elles produisent des AG plus longs, conduisant à des défauts membranaires. De plus, cette synthèse induit une consommation de nutriments plus importante, et par conséquent une dissipation énergétique plus élevée, sans permettre la croissance bactérienne. Ces deux défauts conduisent à la mort bactérienne.
De fait, le mutant ne parvient pas à se développer ex vivo sur tissu humain, ni sur des cellules ou dans des filtrats cellulaires et tissulaires, toutes situations où les nutriments sont limités. Ces caractéristiques expliquent la nécessité de FabT pendant l'infection. Inversement, les mutants fabT présentent un avantage de croissance marqué par rapport à la souche sauvage lorsqu'ils sont exposés aux eAGs saturés, présent par exemple, dans des espaces interstitiels. En effet, les AG saturés sont toxiques suite à leur incorporation par la souche sauvage.
Les scientifiques ont montré que l'activité continue de FASII, telle que dans le mutant fabT, empêche cette incorporation. En outre, des mutants spontanés de fabT ont été obtenus in vitro lors de culture de la souche sauvage en présence d'eAGs saturés. De plus, un modèle ex vivo de muscle, qui est riche en AGs saturés, a révélé que le mutant fabT présente un avantage de croissance marquée comparé à la souche sauvage. En effet, la survie du mutant fabT, ou de SGA sauvage dépend de la localisation de la bactérie.
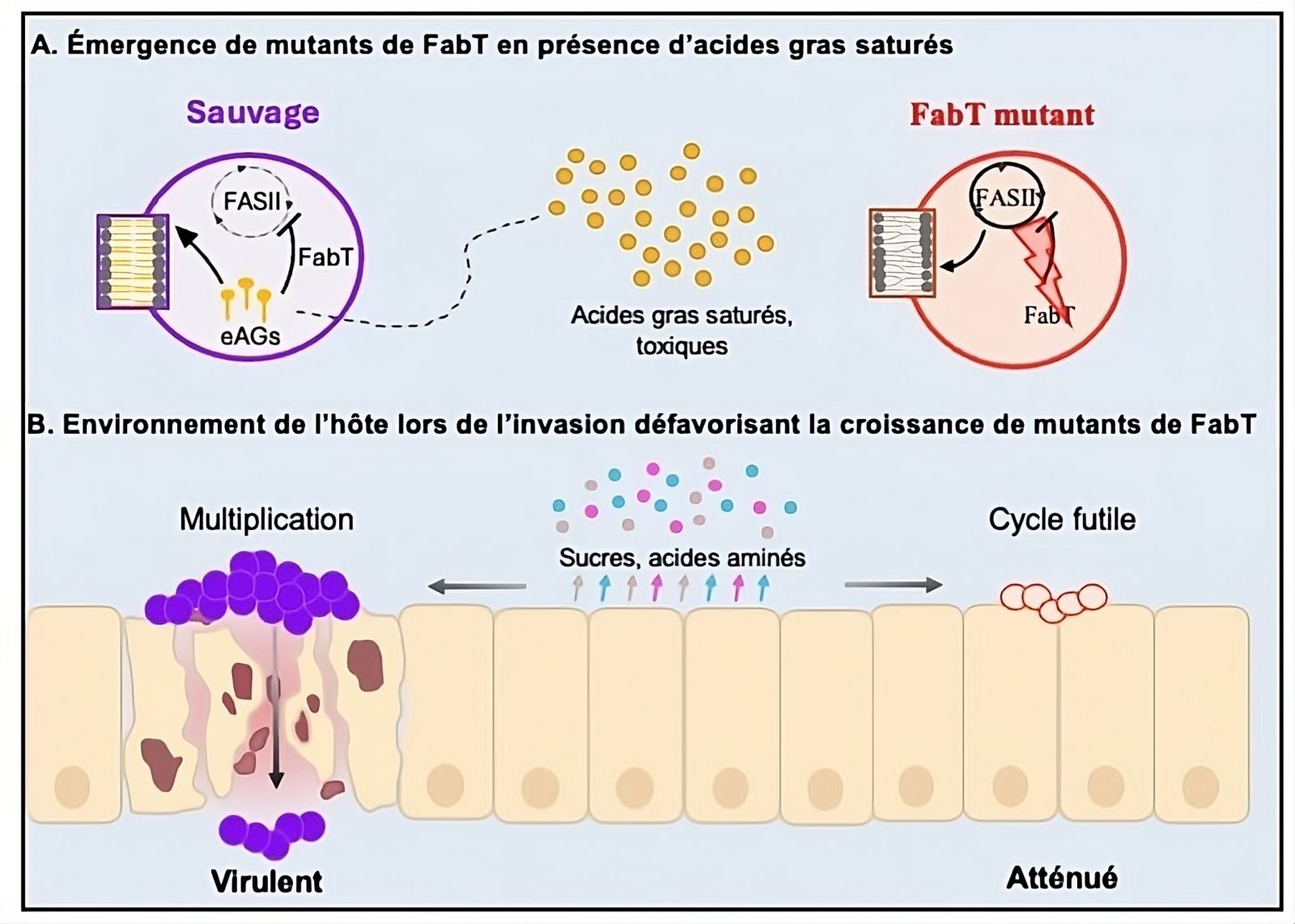
Modèle d'émergence de mutants fabT dont la virulence est atténuée
A: Les acides gras saturés favorisent l'émergence de mutants fabT, résistants à leur toxicité lors du contact initial avec l'hôte.
B: Les mutants fabT subissent un stress métabolique en environnement pauvre en nutriments, limitant leur croissance bactérienne pendant l'infection.
© Clara Lambert, Paprapach Wongdontree, Alexandra Gruss, Agnès Fouet
Ces résultats élucident la raison d'être des mutants fabT émergents qui améliorent la survie dans les biotopes riches en lipides composés d'AGs saturés, mais conduisent à une impasse génétique pour l'infection.
Ces équipes avaient préalablement démontré qu'inhiber la voie FASII n'était pas une option thérapeutique du fait de l'incorporation d'eAG in vivo par différentes espèces bactériennes à Gram positif. La présente étude indique, qu'a contrario rendre la synthèse de FASII constitutive en inhibant FabT, est préjudiciable à l'infection in vivo. FabT est donc une cible thérapeutique potentielle pour de nouvelles thérapies contre des pathogènes à Gram-positif spécifiques, y compris SGA, Streptococcus agalactiae, Streptococcus pneumoniae et Enterococcus faecalis.
Référence:
The double-edged role of FASII regulator FabT in Streptococcus pyogenes infection. Lambert C, Gaillard M, Wongdontree P, Bachmann C, Hautcoeur A, Gloux K, Guilbert T, Méhats C, Prost B, Solgadi A, Abreu S, Andrieu M, Poyart C, Gruss A* and Fouet A*.
4 octobre 2024, Nature Communication, DOI: 10.1038/s41467-024-52637-3