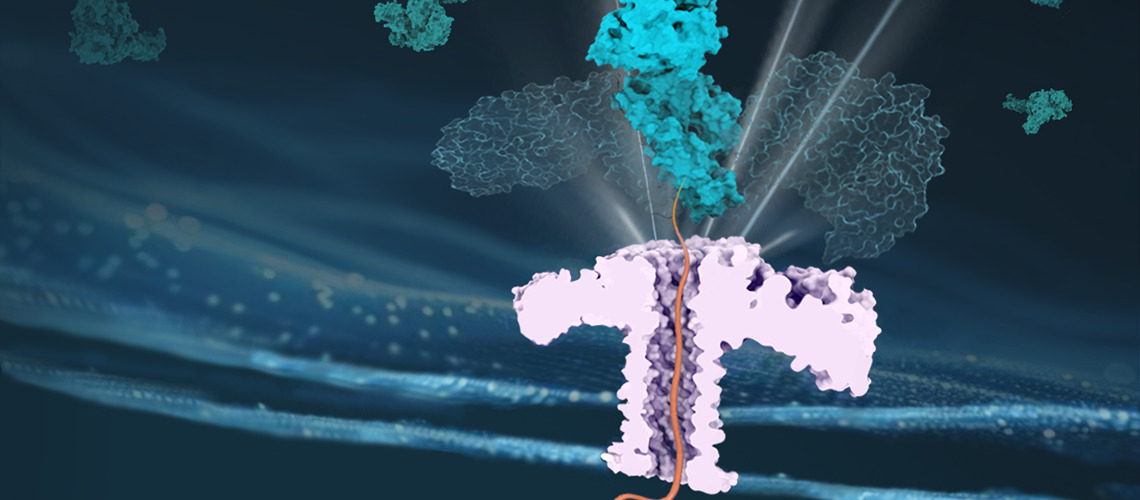
Ein Chaperon-Protein erleichtert den Durchtritt eines anderen Proteins durch eine Nanopore und sorgt so für dessen effizienten Transport.
© Cao - UNIGE
In tierischen und menschlichen Zellen stehen Chaperone der Hsp70-Klasse im Mittelpunkt dieses Kontrollsystems und überwachen eine Vielzahl biologischer Prozesse. Trotz ihrer entscheidenden Rolle blieb ihr genauer molekularer Mechanismus jedoch schwer fassbar.
Durch den Einsatz einer hochentwickelten Nanoporen-Technik ist einem Team der Universität Genf (UNIGE) in Zusammenarbeit mit der EPFL nun ein bedeutender Durchbruch gelungen: Sie haben herausgefunden, wie Hsp70 die notwendige Kraft erzeugt, um die Struktur ihrer Kundenproteine zu manipulieren. Diese Ergebnisse, die ein Jahrzehnt der Debatte beenden, wurden in Nature Communications veröffentlicht.
Damit Proteine ordnungsgemäß funktionieren, müssen sie sich in spezifische dreidimensionale Formen falten. Chaperon-Proteine wie die Hsp70 tragen unter anderem zu dieser Faltung bei. Um diese Aufgaben zu erfüllen, müssen die Hsp70 die Struktur der Proteine mit Kraft manipulieren, sie aus spontan gebildeten Aggregaten extrahieren oder sie durch enge Poren treiben, um sie in wichtige zelluläre Kompartimente, wie Mitochondrien, zu transportieren.
Das Team nutzte die Nanoporentechnologie, um die in vivo-Konfiguration der Proteintranslokation zu reproduzieren.
In den 1990er-Jahren und zu Beginn der 2000er gab es heftige Debatten über den Mechanismus, der es den Hsp70-Chaperonen ermöglicht, die Translokation von Proteinen anzutreiben. Zwei Hauptmodelle wurden vorgeschlagen, die auf unterschiedlichen Experimenten beruhten, aber keine definitive Antwort liefern konnten.
Im Jahr 2006 wurde eine neue Theorie, genannt Entropic Pulling (Entropisches Ziehen), von Professor Paolo De Los Rios von der EPFL und Professor Pierre Goloubinoff von der Universität Lausanne (UNIL) und ihren Teams vorgeschlagen. Das Entropic Pulling konnte alle bisherigen Beobachtungen zur Translokation von Proteinen in Mitochondrien erklären. Es könnte auch auf andere zelluläre Funktionen der Hsp70, wie die Desaggregation von Proteinen, anwendbar sein.
Experimenteller Nachweis
Im Laufe der Jahre ermöglichte es diese Theorie, eine zunehmende Anzahl von Ergebnissen zu interpretieren, blieb jedoch ohne direkte experimentelle Bestätigung. Die Gruppe von Chan Cao, Assistenzprofessorin am Departement für Analytische und Anorganische Chemie der Fakultät für Naturwissenschaften der UNIGE, ist auf die Bioanalyse einzelner Moleküle spezialisiert, insbesondere auf die Nachweisführung durch Nanoporen.
Dieser Ansatz besteht darin, die Reaktion des Ionenstroms zu messen, wenn ein Molekül eine Nanopore durchquert. Die Pore kann aus einem biologischen Protein bestehen, das in eine Lipidmembran integriert ist, oder aus einem hergestellten festen Material. Die Entwicklung der Nanoporentechnologie zielt darauf ab, hochauflösende Detektoren für den Nachweis von Zielmolekülen in komplexen Matrizen und für das Polymere-Sequenzieren zu schaffen.
In dieser jüngsten Arbeit nutzte das Team die Nanoporentechnologie, um die in vivo-Konfiguration der Proteintranslokation nachzubilden. Professorin Chan Cao erklärt: "Unsere Ergebnisse liefern klare Belege für den entropischen Ziehmechanismus der Hsp70-Chaperone und entkräften die beiden zuvor vorgeschlagenen Modelle, nämlich den Power Stroke und den Brownian Ratchet."
Eine starke Kraft auf molekularer Ebene
Im Mechanismus des Entropic Pulling erhöht das Ziehen durch das Chaperon-Protein an der Zielprotein die Möglichkeiten seiner Bewegung, was eine sogenannte entropische Kraft erzeugt. Verena Rukes, Doktorandin und Erstautorin der Studie, erklärt: „Unsere Analyse hat die entropische Zugkraft auf etwa 46 pN über eine Distanz von 1 nm geschätzt, was auf eine bemerkenswert starke Kraft auf molekularer Ebene hinweist.“
Paolo De Los Rios vom Institut für Physik und vom Institut für Bioingenieurwissenschaften der EPFL fügt hinzu: „Unsere im Jahr 2006 vorgeschlagene Theorie erklärte den Großteil der Physik des Systems, das Hsp70, das Translokationsprotein und die Translokationspore umfasst, aber es blieb letztlich eine Theorie, obwohl sie den meisten Beobachtungen indirekt entsprach.
Dank der beeindruckenden Arbeit von Professorin Chan Cao und ihrem Team haben wir nun einen direkten Beweis für diese Theorie und, was am wichtigsten ist, eine quantitative Schätzung ihrer Kraft. Diese erweist sich als bemerkenswert hoch, was erklärt, warum die Hsp70 so effizient die Struktur ihrer Zielproteine verändern können."
Darüber hinaus etablieren diese Arbeiten den Nanoporennachweis als eine leistungsstarke Technik, um die molekularen Mechanismen der Proteinwirkung zu erforschen.