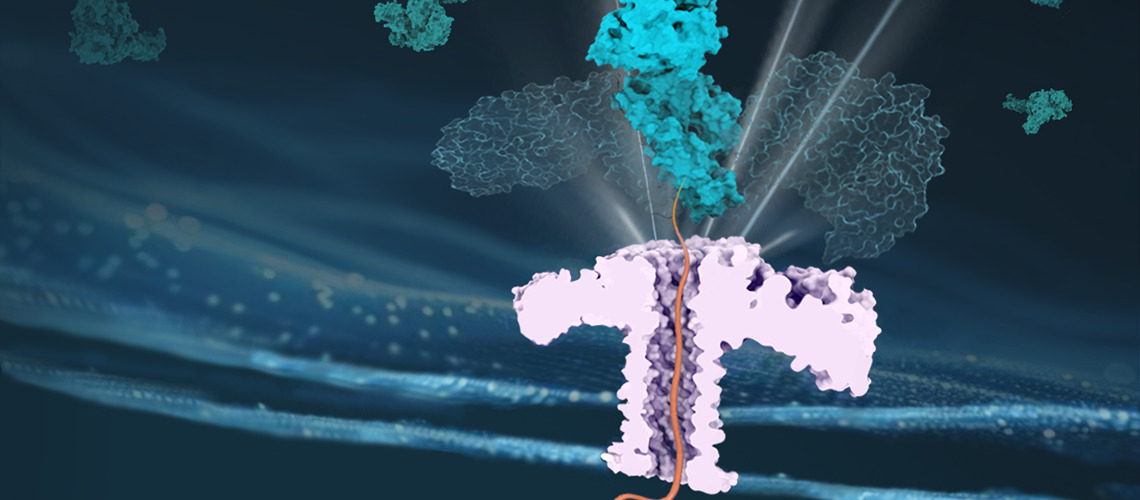
Uma proteína chaperona facilita a passagem de outra proteína através de um nanoporo, garantindo assim seu transporte eficaz.
© Cao - UNIGE
Nas células animais e humanas, as chaperonas da classe Hsp70 estão no centro desse sistema de controle, supervisionando uma ampla gama de processos biológicos. No entanto, apesar de seu papel crucial, seu mecanismo molecular preciso permanecia elusivo.
Utilizando uma técnica avançada de nanoporo, uma equipe da Universidade de Genebra (UNIGE), em colaboração com a EPFL, acaba de fazer uma descoberta significativa determinando como as Hsp70 geram a força necessária para manipular a estrutura de suas proteínas clientes. Estes resultados, que põem fim a uma década de debates, foram publicados na revista Nature Communications.
Para funcionar corretamente, as proteínas devem se dobrar em formas tridimensionais específicas. As proteínas chaperonas, como as Hsp70, contribuem para esse dobramento. Para realizar essas tarefas, as Hsp70 precisam manipular fortemente a estrutura das proteínas, extraindo-as de agregados que se formaram espontaneamente ou fazendo-as passar através de poros estreitos, conduzindo-as para dentro de compartimentos celulares-chave, como as mitocôndrias.
A equipe aproveitou a tecnologia de nanoporos para reproduzir a configuração in vivo da translocação das proteínas.
Durante os anos 1990 e início dos anos 2000, o mecanismo pelo qual as chaperonas Hsp70 conduzem a translocação de proteínas foi alvo de um debate intenso. Dois modelos principais foram propostos com base em diferentes experimentos, mas nenhuma resposta definitiva foi dada.
Em 2006, uma nova teoria, chamada Entropic Pulling (Tração Entrópica), foi proposta pelo professor Paolo De Los Rios da EPFL e pelo professor Pierre Goloubinoff da Universidade de Lausanne (UNIL) e seus colaboradores e colaboradoras. A Tração Entrópica poderia explicar todas as observações existentes sobre a translocação de proteínas nas mitocôndrias. Ela também poderia se aplicar a outras funções celulares das Hsp70, como a desagregação de proteínas.
Prova experimental
Ao longo dos anos, essa teoria permitiu interpretar um número crescente de resultados, mas permaneceu sem confirmação experimental direta. O grupo de Chan Cao, professora assistente do Departamento de Química Analítica e Mineral da Faculdade de Ciências da UNIGE, é especializado na bioanálise de moléculas únicas, em particular a detecção por nanoporos.
Essa abordagem consiste em ler a resposta da corrente iônica quando uma molécula passa por um poro de escala nanométrica. O poro pode ser constituído de uma proteína biológica embutida em uma membrana lipídica ou em um material no estado sólido fabricado. O desenvolvimento da tecnologia de nanoporos visa criar sensores de alta resolução para a detecção de moléculas-alvo em matrizes complexas e para o sequenciamento de polímeros.
Neste trabalho recente, a equipe aproveitou a tecnologia de nanoporos para reproduzir a configuração in vivo da translocação de proteínas. A professora Chan Cao explica: "Nossos resultados fornecem evidências claras do mecanismo de tração entrópica das chaperonas Hsp70, descartando os dois outros modelos anteriormente propostos, ou seja, o Power Stroke e o Brownian Ratchet".
Uma força poderosa em nível molecular
No mecanismo de Entropic Pulling, a proteína chaperona, ao puxar a proteína-alvo, aumenta suas possibilidades de movimento, gerando assim uma força chamada entropica. Verena Rukes, doutoranda e primeira autora do estudo, explica: "Nossa análise estimou a força de tração entrópica em cerca de 46 pN em uma distância de 1 nm, o que indica uma força notavelmente forte em nível molecular".
Paolo De Los Rios, do Instituto de Física e do Instituto de Bioengenharia da EPFL, continua: "Nossa teoria proposta em 2006 explicava a maior parte da física do sistema envolvendo Hsp70, a proteína de translocação e o poro de translocação, mas ainda era apenas uma teoria, mesmo que estivesse indiretamente de acordo com a maioria das observações.
Graças ao magnífico trabalho da professora Chan Cao e sua equipe, agora temos uma prova direta dessa teoria e, o mais importante, uma estimativa quantitativa de sua força. Esta força é surpreendentemente alta, o que explica por que as Hsp70 são tão eficazes em modificar a estrutura de suas proteínas-alvo".
Além disso, este trabalho estabelece o método de detecção por nanoporos como uma técnica poderosa para explorar os mecanismos moleculares da ação das proteínas.