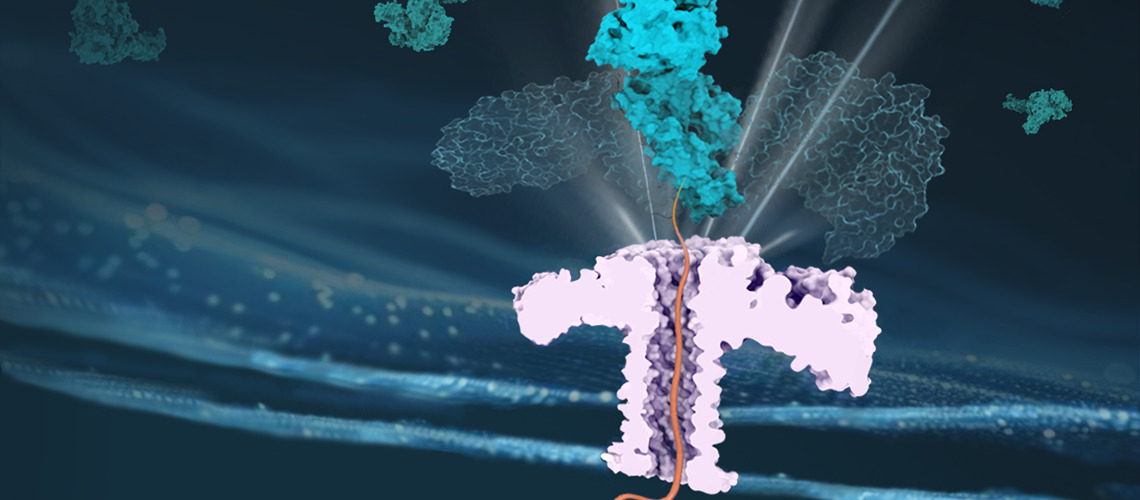
Una proteína chaperona facilita el paso de otra proteína a través de un nanoporo, asegurando así su transporte eficaz.
© Cao - UNIGE
En las células animales y humanas, las chaperonas de la clase Hsp70 están en el corazón de este sistema de control, supervisando una amplia gama de procesos biológicos. Sin embargo, a pesar de su papel crucial, su mecanismo molecular preciso había sido esquivo.
Utilizando una técnica de punta de nanoporo, un equipo de la Universidad de Ginebra (UNIGE), en colaboración con la EPFL, acaba de realizar un avance significativo al determinar cómo las Hsp70 generan la fuerza necesaria para manipular la estructura de sus proteínas cliente. Estos resultados, que ponen fin a una década de debate, han sido publicados en Nature Communications.
Para funcionar correctamente, las proteínas deben plegarse en formas tridimensionales específicas. Las proteínas chaperonas, como las Hsp70, contribuyen notablemente a este plegamiento. Para llevar a cabo estas tareas, las Hsp70 deben manipular con fuerza la estructura de las proteínas, extrayéndolas de los agregados que se han formado espontáneamente o haciéndolas pasar a través de poros estrechos, para guiarlas hacia compartimentos celulares clave, como las mitocondrias.
El equipo aprovechó la tecnología de nanoporos para reproducir la configuración in vivo de la translocación de proteínas.
Durante los años 1990 y principios de los 2000, el mecanismo que permitía a las chaperonas Hsp70 impulsar la translocación de proteínas fue objeto de un intenso debate. Se propusieron dos modelos principales basados en diferentes experimentos, pero no se llegó a una respuesta definitiva.
En 2006, se propuso una nueva teoría, llamada Entropic Pulling (Tracción Entrópica), por el profesor Paolo De Los Rios de la EPFL y el profesor Pierre Goloubinoff de la Universidad de Lausana (UNIL) y sus colaboradores y colaboradoras. La Tracción Entrópica podría explicar todas las observaciones existentes sobre la translocación de proteínas en las mitocondrias. También podría aplicarse a otras funciones celulares de las Hsp70, como la desagregación de proteínas.
Prueba experimental
A lo largo de los años, esta teoría permitió interpretar un número creciente de resultados, pero seguía sin confirmación experimental directa. El grupo de Chan Cao, profesora asistente en el Departamento de Química Analítica e Inorgánica de la Facultad de Ciencias de la UNIGE, está especializado en el bioanálisis de moléculas individuales, particularmente en la detección mediante nanoporos.
Este enfoque consiste en leer la respuesta de la corriente iónica cuando una molécula atraviesa un poro de escala nanométrica. El poro puede estar constituido por una proteína biológica incrustada en una membrana lipídica o en un material sólido fabricado. El desarrollo de la tecnología de nanoporos tiene como objetivo crear sensores de alta resolución para la detección de moléculas objetivo en matrices complejas y para la secuenciación de polímeros.
En este trabajo reciente, el equipo aprovechó la tecnología de nanoporos para reproducir la configuración in vivo de la translocación de proteínas. La profesora Chan Cao explica: "Nuestros resultados aportan pruebas evidentes del mecanismo de tracción entrópica de las chaperonas Hsp70, descartando los otros dos modelos previamente propuestos, a saber, el Power Stroke y el Brownian Ratchet".
Una fuerza poderosa a nivel molecular
En el mecanismo de Entropic Pulling, la proteína chaperona, al tirar de la proteína objetivo, incrementa sus posibilidades de movimiento, generando así una fuerza denominada entrópica. Verena Rukes, doctoranda y primera autora del estudio, explica: "Nuestro análisis estimó la fuerza de tracción entrópica en aproximadamente 46 pN sobre una distancia de 1 nm, lo que indica una fuerza notablemente fuerte a nivel molecular".
Paolo De Los Rios, del Instituto de Física y del Instituto de Bioingeniería de la EPFL, prosigue: "Nuestra teoría propuesta en 2006 explicaba la mayor parte de la física del sistema que comprende Hsp70, la proteína de translocación y el poro de translocación, pero seguía siendo una teoría, aunque coincidía indirectamente con la mayoría de las observaciones.
Gracias al magnífico trabajo de la profesora Chan Cao y su equipo, ahora tenemos una prueba directa de esta teoría y, lo que es más importante, una estimación cuantitativa de su fuerza. Resulta ser notablemente alta, lo que explica por qué las Hsp70 son tan eficaces para modificar la estructura de sus proteínas objetivo".
Además, estos trabajos establecen la detección por nanoporos como una técnica poderosa para explorar los mecanismos moleculares de la acción de las proteínas.