Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
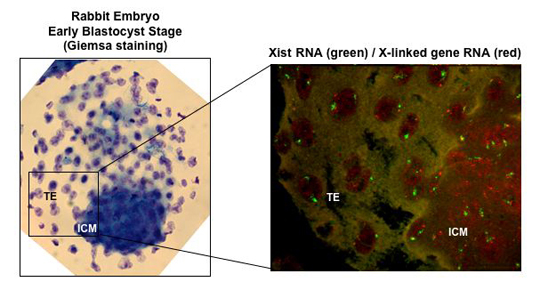
Inactivation d'un chromosome X dans un embryon de lapin au stade blastocyste, où l'on peut voir les cellules du trophectoderme (TE) et celles de la masse interne (ICM). La technique d'hybridation fluorescente in situ permet de visualiser l'accumulation de l'ARN Xist (en vert) et de déterminer la présence ou l'absence du transcrit primaire (en rouge) d'un gène du chromosome X. © GBD, I. Okamoto
La paire de chromosomes sexuels (XY chez les mâles, XX chez les femelles) est responsable de la détermination du sexe chez les mammifères. Mais contrairement au X, le chromosome Y est petit et ne porte que très peu de gènes. Au cours du développement embryonnaire précoce, l'un des deux chromosomes X des femelles passe donc d'un état actif à un état inactif et hétérochromatique, connu sous le nom de corpuscule de Barr. Ce processus d'inactivation aboutit à l'extinction transcriptionnelle de plusieurs milliers de gènes et assure ainsi la compensation de dose entre les sexes. Mais de manière remarquable, le processus d'inactivation ne touche que l'un des deux chromosomes X, tandis que son homologue reste actif dans le noyau.
Le transcrit non-codant Xist est un ARN essentiel au démarrage du mécanisme d'inactivation: il s'accumule le long du chromosome X à partir duquel il est transcrit, puis l'inactive en cis, en induisant des changements dans la structure de la chromatine. Par contre, une fois établie, l'inactivation est stable et le chromosome inactivé est alors "cloné" au fil des divisions cellulaires.
Chez la souris, qui constitue un modèle privilégié d'étude du phénomène, l'inactivation du chromosome X se fait en deux phases, au cours du développement précoce de l'embryon. Le chromosome X paternel est tout d'abord inactivé par l'empreinte de l'ARN Xist, durant la période préimplantatoire, dès le stade "2 cellules". Dans le blastocyste, au stade "64 cellules", le chromosome X paternel reste inactif dans les cellules périphériques, qui formeront le placenta. En revanche, il est réactivé dans les cellules de la masse interne qui donneront le futur embryon . La seconde vague d'inactivation a lieu dans les cellules de l'embryon et touche cette fois ci aléatoirement le chromosome X d'origine paternelle ou maternelle dans chaque cellule. Mais tandis que la régulation de l'inactivation du chromosome X, soumise à l'empreinte Xist ou aléatoire, semble extrêmement efficace chez la souris, aucune étude détaillée n'a jusqu'à ce jour été effectuée sur d'autres mammifères.
Ainsi, les équipes d'Edith Heard au sein de l'unité de Génétique et Biologie du Développement (GBD) et de Véronique Duranthon au laboratoire de Biologie du Développement et de la Reproduction (BDR), se sont intéressées au degré de conservation des mécanismes épigénétiques qui régulent l'inactivation du chromosome X chez différents mammifères. Les chercheurs ont montré que dans les embryons précoces de lapin et d'Homme, la mise en place de cette inactivation suit une cinétique bien différente de celle qui existe chez la souris. L'expression soumise à l'empreinte du gène Xist et l'inactivation du chromosome X à partir du chromosome paternel semblent d'ailleurs spécifiques des rongeurs. Chez le lapin, l'expression de Xist est régulée de façon sexe-dépendante, mais dans les blastocystes femelles, il peut cependant être exprimé par les deux chromosomes X et initier l'inactivation de ces deux chromosomes au sein de la même cellule. Dans les blastocystes humain, l'expression de Xist est observée pour les deux sexes et pour les deux chromosomes X chez les embryons femelles. Chez l'Homme, l'inactivation du chromosome X ne semble néanmoins pas être initiée à ce stade de 64 cellules.
Ces résultats, obtenus avec la collaboration de l'Institut Cochin (CNRS/Inserm/Université Paris Descartes) et du Service de Biologie de la Reproduction de l'Assistance Publique Hôpitaux de Paris, mettent en évidence que les observations préalablement faites chez la souris ne peuvent pas être étendues aux autres espèces de mammifères. Ils permettent néanmoins de mieux comprendre l'évolution de la compensation de dose chez les mammifères et sont d'une grande importante pour les recherches qui portent sur les cellules souches embryonnaires pluripotentes de l'Homme, qui sont dérivées de la masses interne du blastocyste.