Des nanotubes fonctionnalisés pour stabiliser et augmenter la capacité des batteries Li-soufre
Publié par Redbran,
Source: CEA-IRAMISAutres langues:
Source: CEA-IRAMISAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Les systèmes obtenus offrent une excellente stabilité en cyclage et une capacité spécifique prometteuse. Ce travail est publié dans la revue ChemElectroChem.
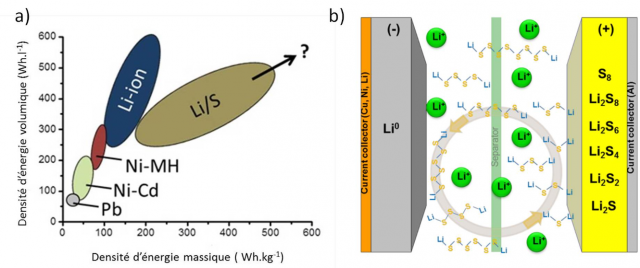
Figure 1 - a) Comparaison des densités d'énergie massiques de divers systèmes par rapport au système Li-S. b) Principe général d'une batterie Li-S ; au contraire des systèmes Li-ion basés sur des réactions d'intercalation d'ions lithium, la décharge se fait par rupture des liaisons S-S et dissolution de la matière active dans l'électrolyte.
Les batteries lithium-ion (Li-ion) équipent la majorité des appareils électroniques portables. Cependant, leurs performances semblent atteindre progressivement un palier et les recherches se tournent actuellement vers de nouveaux systèmes comme les batteries lithium-soufre et lithium-organique. Ces derniers offrent des capacités théoriques attractives et/ou des coûts et une toxicité des matières premières a priori faibles. Pour le Li-Soufre (Li-S), la densité d'énergie théorique, de l'ordre de 2500 Wh·kg-1, est un ordre de grandeur supérieure à celle des batteries Li-ion (environ 250 Wh·kg-1).[1,2]. Contrairement aux batteries Li-ion pour lesquelles le lithium est sous forme de cation Li+, dans les batteries Li-S, l'électrode négative est constituée de lithium métallique et la réaction de décharge fait intervenir la rupture des liaisons S-S (Figure ci-dessus).
Les accumulateurs Li-S souffrent néanmoins de plusieurs limitations: le soufre élémentaire est un très mauvais conducteur électronique et l'ajout d'un conducteur électronique est incontournable, ce qui diminue d'autant la capacité pratique des accumulateurs. D'autre part, lors de la décharge, la réaction du soufre élémentaire avec le lithium entraine la formation de polysulfures de lithium qui sont solubles dans l'électrolyte, ce qui entraine une perte de la masse active à l'électrode, un phénomène d'autodécharge (corrosion de l'électrode négative) et une perte de capacité importante au cours des premiers cycles.
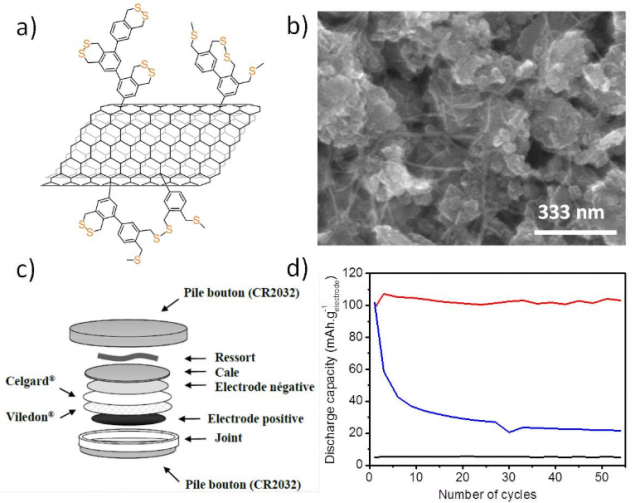
Figure 2 - a) représentation des nanotubes fonctionnalisés ; b) image MEB de nanotubes fonctionnalisés ; c) représentation schématique des piles boutons utilisées pour tester les matériaux d'électrode positive ; d) rétention de capacité d'échantillons de MWNTs purifiés (noir), MWNTs simplement mélangés avec la molécule soufrée (bleu), MWNT fonctionnalisés de manière covalente avec la molécule soufrée (rouge).
Pour contrer ces limitations, les équipes du CEA ont fonctionnalisé de manière covalente des MWNTs avec les molécules contenant des ponts disulfures. Les matériaux d'électrodes positives constitués de nanotubes greffés autosupportés ont été intégrés à des piles boutons puis évalués sur un banc de test (cycles de charge/décharge à courant constant). Les résultats obtenus avec les molécules soufrées greffées sont prometteurs puisque la capacité obtenue est de 100 mAh·g-1 d'électrode, alors qu'elle n'est que d'environ 5 mAh·g-1 pour les nanotubes de carbone seuls. Cette valeur reste inférieure à celles obtenues pour les meilleures batteries Li-ion et Li-S conventionnel (400 mAh·g-1d'électrode à ce jour). Néanmoins, ces accumulateurs se caractérisent par leur excellente stabilité par rapport aux systèmes Li-S classiques dans la mesure où 98 % de la capacité initiale est conservée après 50 cycles (Figure 2).[3]
Note:
[1] “Advances in Li-S batteries”,
X. Ji and L. F. Nazar, J. Mater. Chem., 20, 9821-9826 (2010).
[2] “Li-O2 and Li-S batteries with high energy storage”,
P. G. Bruce, S. A. Freunberger, L. J. Hardwick and J.-M. Tarascon, Nat. Mater., 11, 19-29 (2011)
[3] “Sulfur containing molecules grafted on carbon nanotubes ad highly cyclable cathodes for lithium/organic batteries”,
G. Charrier, H. Kamaleddine, C. Barchasz, R. Cornut, B. Jousselme and S. Campidelli, ChemElectroChem (2018).
Contact CEA-IRAMIS:
Stéphane Campidelli (NIMBE/LICSEN)
Collaboration:
Céline Barchasz: DRT/LITEN/DEHT/STB Laboratoire des Matériaux (LM), CEA-Grenoble, 17 rue des Martyrs, 38054 Grenoble Cedex 9, France.
• Matériaux des nouvelles technologies pour l'énergie › Matériaux nanostructurés pour l'énergie
• UMR 3685 NIMBE: Nanosciences et Innovation pour les Matériaux, la Biomédecine et l'Énergie
• Laboratoire d'Innovation en Chimie des Surfaces et Nanosciences (LICSEN)