Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
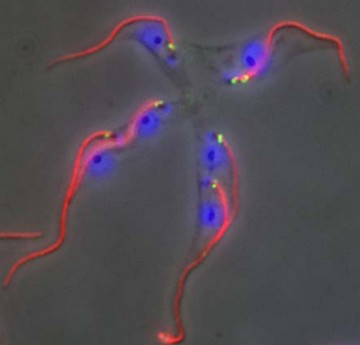
La protéine BILBO1, talon d'Achille de Trypanosoma brucei brucei.
Marquage par immunofluorescence de BILBO1 (vert),
des flagelles (rouge) et des noyaux (bleu)
superposé avec le contraste de phase de quatre parasites en culture
Véritable problème de santé publique et économique en Afrique sub-saharienne, la maladie du sommeil menace potentiellement 60 millions de personnes réparties sur près de 36 pays africains. On estime actuellement que 50 000 à 70 000 personnes sont infectées. Cette maladie, toujours mortelle en l'absence de traitement (1), est provoquée par un parasite unicellulaire appelé trypanosome, lui-même transmis par la piqûre de la "fameuse" mouche tsé-tsé.
Le trypanosome vit dans le sang, la moelle osseuse et une zone spécifique du cerveau nommée liquide céphalo-rachidien. Il possède un constituant cellulaire original: la poche flagellaire. "Multi-fonctions, elle est en quelque sorte le tendon d'Achille du parasite", précise Derrick Robinson, chargé de recherche CNRS au laboratoire "Microbiologie cellulaire et moléculaire et pathogénicité" (2). A son niveau, émerge le flagelle qui assure le déplacement du parasite. De plus, cette poche est l'unique lieu d'endocytose et d'exocytose (3). Ces deux processus permettent les échanges de "matériels" entre le parasite et son milieu environnant.
S'intéressant à l'espèce Trypanosoma brucei brucei, spécifique des animaux, l'équipe de Derrick Robinson a identifié une nouvelle protéine, appelée BILBO1, nécessaire à la genèse de la poche flagellaire chez ce parasite.
Allant plus loin, les chercheurs ont mis en évidence que BILBO1 est responsable de la formation d'une structure particulière du cytosquelette (charpente de la cellule), qui soutient la poche flagellaire. Surtout, lorsque la protéine n'est pas exprimée dans le parasite, la cellule mère est incapable de fabriquer une nouvelle poche nécessaire à la production d'une cellule fille. Ce trypanosome "aberrant" s'avère alors incapable d'avoir des échanges avec le milieu environnant et, par voie de conséquence, d'incorporer des nutriments assurant sa survie. Par accumulation de déchets qui ne peuvent être expulsés via exocytose, les cellules gonflent, ne se déplacent plus correctement et ne se divisent plus. Il suffit donc de bloquer BILBO1 pour que le parasite soit anéanti.
Ces résultats laissent entrevoir des perspectives thérapeutiques prometteuses. Ils permettent d'envisager l'utilisation de la protéine BILBO1 comme nouvelle cible pour des médicaments trypanocides.
Notes:
(1) Les traitements existants sont chers, toxiques et difficiles à administrer sur le terrain.
(2) CNRS / Université Bordeaux 2.
(3) Lors de l'endocytose, la membrane de la poche flagellaire enveloppe et absorbe une particule. Au cours de l'exocytose, c'est le phénomène inverse qui se produit: la particule est expulsée hors de la membrane.