Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
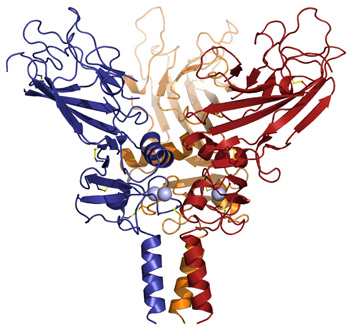
Structure tridimensionnelle de la forme trimérique des C-propeptides de procollagène humain.
Les trois brins sont représentés dans des couleurs différentes.
© Bourhis et al. Cette image est disponible à la photothèque du CNRS, [email protected]
Les collagènes représentent 25% de la masse totale des protéines d'un individu et ont pour fonction de conférer aux tissus leur intégrité structurelle et fonctionnelle. Principaux constituants de la matrice extracellulaire, ils assurent l'organisation et le bon fonctionnement de nombreux tissus, notamment la peau, la cornée, le squelette et le système cardiovasculaire. Mais un dépôt excessif de collagène ou des mutations dans les gènes codant pour ces protéines peuvent engendrer plusieurs maladies graves.
Les précurseurs du collagène sont des molécules constituées de trois brins de procollagène synthétisés dans les cellules. Ces molécules sont sécrétées vers la matrice extracellulaire où, à la suite d'un processus de maturation, elles s'assemblent en longues fibres de collagène. Ces deux processus, l'assemblage de la molécule puis l'assemblage de la fibre, sont contrôlés par le C-propeptide, domaine constitué de 245 acides aminés situés à l'une des extrémités de chaque brin de procollagène. Les mutations dans les gènes du procollagène sont responsables de nombreuses pathologies, souvent mortelles, telles que l'ostéogenèse imparfaite ou les chondrodysplasies (1). Certaines de ces mutations touchent le C-propeptide.
Afin de concevoir de nouvelles stratégies thérapeutiques et de mieux comprendre le fonctionnement du C-propeptide, les chercheurs (2) ont déterminé sa structure tridimensionnelle grâce à la cristallographie aux rayons X. Ils ont ainsi pu cartographier les nombreuses mutations présentes dans les C-propeptides et les corréler avec la sévérité des pathologies associées. La structure 3D ainsi établie pourrait devenir un outil de pronostic pour prédire a priori les conséquences des mutations.
Connaître la structure de ce domaine pourrait aussi permettre à l'avenir de contrôler la formation de fibres de collagène dans la matrice extracellulaire. En effet, pour que ces fibres puissent se tresser, les C-propeptides doivent être éliminés grâce à des enzymes spécifiques. Autrement dit, si l'on parvenait à empêcher ou ralentir l'élimination du C-propeptide, on pourrait diminuer la production de fibres de collagène. De plus, une meilleure connaissance du mécanisme d'action du C-propeptide pourrait aussi permettre d'empêcher l'association des trois brins de procollagène à l'intérieur des cellules. Ce qui pourrait permettre de prévenir les fibroses, graves maladies résultant d'une accumulation excessive de collagène dans certains organes comme le cœur, les reins, le foie ou les poumons.
Ces travaux qui ont reçu le soutien de la Fondation de France et de l'Agence Nationale de la Recherche constituent une étape importante vers l'obtention de molécules thérapeutiques et ont fait l'objet d'un dépôt de brevet.
Notes:
(1) Troubles du développement des os et des cartilages aboutissant à des anomalies morphologiques et des troubles du développement osseux.
(2) laboratoires: Dysfonctionnements de l'homéostasie tissulaire et ingénierie thérapeutique (CNRS/Université Claude Bernard Lyon 1), Bases moléculaires et structurales des systèmes infectieux (CNRS/Université Claude Bernard Lyon 1), Biologie structurale des interactions entre virus et cellule-hôte (CNRS/Université Joseph Fourier/EMBL), Wellcome Trust Centre for Human Genetics, (University of Oxford).
Référence:
“Structural Basis of Fibrillar Collagen Trimerization and Related Genetic Disorders”, Jean-Marie Bourhis, Natacha Mariano, Yuguang Zhao, Karl Harlos, Jean-Yves Exposito, E.Yvonne Jones, Catherine Moali, Nushin Aghajari, David J.S. Hulmes, Nature Structural and Molecular Biology (2012), published on line 23 September 2012 (doi 10.1038/nsmb.2389)