Plus de 7000 protéines pour fabriquer un globule rouge
Publié par Adrien,
Source: CNRS-INSBAutres langues:
Source: CNRS-INSBAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
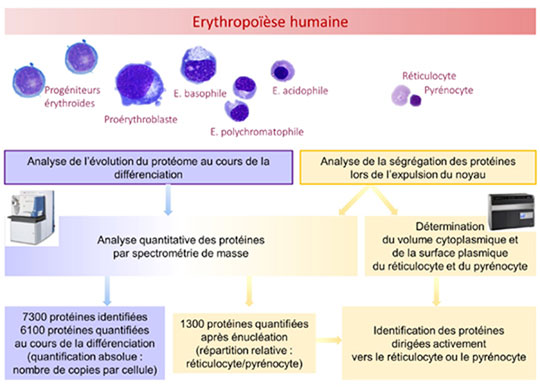
Figure: Schéma général de l'étude. Lors de l'érythropoïèse humaine, les progéniteurs érythroïdes (cellules immatures engagées dans la différenciation en globules rouges) prolifèrent et se différencient en passant par différents stades reconnaissables morphologiquement. En fin de différenciation, l'érythroblaste acidophile expulse son noyau entouré d'un fin halo de cytoplasme et d'une membrane plasmique (le pyrénocyte).
En utilisant une approche de protéomique quantitative par spectrométrie de masse, 7300 protéines exprimées par les cellules érythroïdes humaines lors de leur différenciation ont été identifiées. 6100 de ces protéines ont été quantifiées en nombre de copies par cellule. La répartition de 1300 d'entre-elles entre le réticulocyte et le pyrénocyte a été mesurée.
La détermination du volume cytoplasmique et de la surface de chaque particule a permis de préciser pour chaque protéine, si elle est activement dirigée vers l'une ou l'autre des particules ou si elle suit passivement la répartition quantitative du compartiment où elle se trouve. (E. = érythroblaste).
© Patrick Mayeux, Anna Raimbault, Emilie-Fleur Gautier, Marjorie Leduc
Plusieurs types cellulaires se succèdent lors de la différenciation des érythrocytes. Les premiers dénommés BFU-E et CFU-E se multiplient intensément avec peu de modifications morphologiques. Ils donnent naissance aux précurseurs: pro-érythroblastes, érythroblastes basophiles, polychromatophiles puis acidophiles qui prolifèrent peu mais acquièrent les protéines spécifiques des globules rouges. Finalement, l'érythroblaste acidophile expulse son noyau pour former un réticulocyte qui termine sa maturation d'abord dans la moelle osseuse puis dans la circulation sanguine pour donner naissance à un globule rouge. Plusieurs équipes ont décrit l'évolution du transcriptome des cellules érythroïdes au cours de leur différenciation mais aucune analyse globale du protéome n'avait été rapportée.
L'équipe de Patrick Mayeux et la plateforme de protéomique de l'Université Paris Descartes (3P5) ont établi pour la première fois le protéome des cellules érythroïdes humaines au cours de leur différenciation. Plus de 7300 protéines ont ainsi pu être identifiées dont 6100 quantifiées en nombre de copies par cellule depuis les progéniteurs de type BFU-E jusqu'aux érythroblastes acidophiles. En plus de tous les facteurs de transcription connus pour jouer un rôle spécifique dans l'érythropoïèse (ce qui valide la qualité des échantillons et des méthodes employées), un grand nombre de protéines dont l'expression dans ces cellules n'était pas suspectée, ont été identifiées et quantifiées ce qui ouvre la voie à de nombreuses pistes dans la compréhension fine de la différenciation érythroïde.
Réalisée en collaboration avec l'équipe de N. Mohandas (New-York Blood Center. USA), la comparaison du transcriptome et du protéome des progéniteurs érythroïdes a révélé de nombreuses divergences. Ces divergences entre le protéome et le transcriptome sont fréquemment retrouvées dans la plupart des autres modèles cellulaires déjà étudiés. En analysant les divergences les plus notables, les chercheurs ont mis en évidence qu'un processus de rétention d'introns (lors de la maturation des ARN messagers) récemment décrit au cours des dernières étapes de l'érythropoïèse, contribue à cette différence entre le transcriptome et le protéome.
Enfin, en collaboration avec l'équipe de L. Douay (hôpital Saint-Antoine, Paris), l'équipe a comparé la répartition de plus de 1300 protéines entre la particule contenant le noyau (le pyrénocyte) et le réticulocyte lors de l'énucléation. Le volume cytoplasmique et la surface plasmique de chaque particule ont été déterminés par une technique d'imagerie couplée à la cytométrie en flux. Cette étude a permis de mettre en évidence que de nombreuses protéines n'ont pas une répartition aléatoire mais sont dirigées activement vers l'une ou l'autre des particules lors de la perte du noyau.
Ce travail constitue la première analyse quantitative absolue de l'évolution d'un protéome cellulaire au cours d'un processus de différenciation complexe chez l'homme. La quantification absolue des protéines à haut débit, maintenant possible grâce aux progrès de l'analyse protéomique, ouvre la voie à de nombreux travaux de modélisation du fonctionnement cellulaire. Par ailleurs, ces travaux sur l'érythropoïèse normale permettent maintenant de rechercher précisément les mécanismes de pathologies graves impliquant l'érythropoïèse chez l'homme, comme la drépanocytose, l'anémie de Blackfand-Diamond ou les thalassémies dont les causes moléculaires sont connues mais dont les conséquences des mutations responsables de ces pathologies sur le fonctionnement cellulaire général restent largement incomprises.