Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
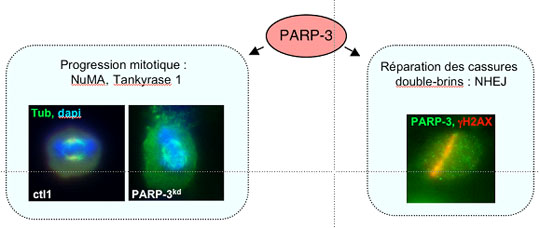
Figure: La protéine PARP-3 est à la croisée entre la réponse cellulaire aux cassures double-brin et la progression mitotique. A gauche, contrairement à une cellule contrôle (ctl1), une cellule déplétée en PARP-3 (PARP-3kd) présente un fuseau mitotique désorganisé. A droite, l'immunofluorescence montre une colocalisation de PARP-3 endogène (en vert) et du marqueur des cassures double-brins ?H2AX (en rouge) au niveau des sites de cassures de l'ADN, obtenus après microirradiation laser. © BSC, F. Dantzer
La poly-ADP-ribosylation a été découverte par Pierre Chambon et Paul Mandel en 1963. Il s'agit d'une modification post-traductionnelle de protéines, catalysée par les Poly(ADP-ribose) Polymérases (PARP), une famille de 17 enzymes. Parmi celles-ci, PARP-1 et PARP-2 sont les plus étudiées à ce jour et sont maintenant reconnues comme des protéines clés de la stabilité du génome et de la réparation de l'ADN. Ces propriétés confèrent ainsi aux inhibiteurs de PARP le pouvoir innovant d'affecter les cellules cancéreuses dans leur capacité à réparer leur génome. Cette voie apparaît donc comme l'une des plus prometteuses actuellement pour augmenter la cytotoxicité des chimiothérapies ou radiothérapies et en monothérapie, pour cibler des cancers associés à une mutation des gènes BRCA1 ou BRCA2 suppresseurs de tumeurs, tels que les cancers du sein, de l'ovaire ou de la prostate.
Le troisième membre de la famille des PARP, PARP-3, a en partie été découvert par Gilbert de Murcia, mais cette enzyme était jusqu'alors peu caractérisée d'un point de vu fonctionnel. Les derniers travaux de l'équipe de Françoise Dantzer et Valérie Schreiber au sein de l'unité Biotechnologie et Signalisation Cellulaire (BSC, CNRS/Université de Strasbourg), ont permis de décrire PARP-3 comme un nouvel acteur de la réponse cellulaire aux cassures double-brin de l'ADN. La réparation de telles cassures peut se faire par jonction ou recombinaison des extrémités non-homologues au cours d'un processus dit "Non-Homologue End-Joining" (NHEJ). Une précédente étude a déjà mis en évidence que PARP-3 facilitait en fait l'étape de ligation des extrémités de la cassure. Les chercheurs ont pu confirmer ce résultat en montrant que les cellules humaines déplétée en PARP-3 présentent un délai significatif dans la réparation de ces cassures et que les souris déficientes à la fois en PARP-1 et en PARP-3 présentent une hypersensibilité accrue aux radiations ionisantes. Ils tentent maintenant de décortiquer les mécanismes moléculaires qui sont mis en jeu.
D'autre part, grâce à des approches biochimiques et des études d'interaction protéique, les scientifiques ont également pu identifier PARP-3 comme un régulateur essentiel de la progression de la mitose, qui contrôlerait la dynamique du fuseau mitotique et l'intégrité des télomères. En effet, ils ont observé une interaction physique et fonctionnelle entre PARP-3, le facteur mitotique NuMA et la protéine télomérique Tankyrase 1. Les chercheurs ont alors montré que PARP-3 stimule la poly(ADP-ribosyl)ation de NuMA et sa fonction dans la dynamique du fuseau mitotique. En conséquence, la déplétion de PARP-3 dans des cellules humaines entraîne des perturbations dans la structure du fuseau mitotique et dans la séparation des télomères, conduisant ainsi à un arrêt de la progression mitotique en métaphase et dans un grand nombre de cas à une mort cellulaire.
Ces résultats, obtenus en collaboration avec le laboratoire Cellules Souches et Radiations (Inserm/CEA/Université Paris Diderot) et avec la participation de l'Institut Pluridisciplinaire Hubert Curien (IPHC, CNRS/Université de Strasbourg), de l'unité Modèles de Cellules Souches Malignes et Thérapeutiques (Inserm/Université Paris-Sud), de la Ludwig Maximilian University de Munich et de la New York University School of Medicine, ouvrent des perspectives de recherche attrayantes pour le développement de stratégies thérapeutiques nouvelles contre le cancer qui auraient pour cible la protéine PARP-3. Actuellement, les chercheurs tentent de déterminer précisément son rôle dans la cancérogenèse.