Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Des travaux récents sur les métaux alcalins suggèrent que des hautes pressions ne provoquent pas toujours des agencements moléculaires et atomiques simples et symétriques. L'étude du sodium, cependant, est la première à prouver qu'à mesure que les pressions augmentent, la température requise pour fondre une substance diminue effectivement sur un intervalle étendu de pressions. L'eau agit pareillement, mais sur un intervalle minuscule de pression. La fonte fait flotter la glace car l'eau est plus dense et plus tassée que le solide. Mais le sodium fond à des températures de plus en plus basses sur un énorme intervalle de pression.
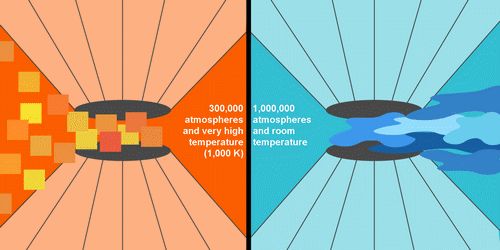
"Nous ne comprenons pas le processus", commente Gregoryanz. "Nous savons que la fusion se produit quand les atomes ou les molécules ne sont pas maintenus ensemble. Des températures en général plus élevées sont nécessaires pour fondre la matière sous haute pression parce que les atomes ou les molécules sont associés plus étroitement et donc nécessitent une plus grande impulsion thermique pour se déplacer". A pression ambiante, le sodium fond à 98°C. Au fur et à mesure que la pression augmente, jusqu'à 300.000 fois la pression atmosphérique au niveau de la mer, la température de fusion s'élève comme prévu. "C'est ensuite que des choses étranges ont commencé à se produire et que l'expérience s'est corsée", raconte Gregoryanz.
De 300.000 jusqu'à pratiquement 1,2 million d'atmosphères, la température de fusion a en fait diminué, jusqu'à 27°C, 71 degrés plus bas que pour fondre le sodium sous les conditions normales. "Le résultat le plus intéressant est peut-être que sous une pression de 1 million d'atmosphères le sodium fond à température ambiante", indique Olga Degtyareva, cristallographe au Laboratoire de Géophysique. "Les atomes dans le sodium figé à ces pressions possèdent un arrangement étrange et complexe".
Dans la suite de l'expérience, pour des pressions allant de 1,2 million d'atmosphères jusqu'à 1,3 million d'atmosphères, la température de fusion a recommencé à s'élever jusqu'à atteindre 127°C, une température de fusion encore exceptionnellement basse.
Les résultats de cette recherche ont engendré beaucoup de questions nouvelles sur le comportement de la matière. Les scientifiques attendent avec intérêt d'examiner en particulier les propriétés des liquides à température ambiante sous une pression de 1 million d'atmosphères. Ils supposent pouvoir découvrir un certain nombre de caractéristiques peu communes, y compris une éventuelle supraconductivité de ces liquides.