Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Les télomères, des capuchons situés à l'extrémité des chromosomes et servant à protéger l'information génétique, s'érodent à chaque division cellulaire. Francis Rodier et son équipe ont démontré que l'arrêt de la division cellulaire causé par le dysfonctionnement du télomère est si instable qu'il finit par créer des anomalies génétiques. Crédit: Getty
Cette découverte va à l'encontre du modèle scientifique en vogue depuis 15 ans. Celui-ci repose sur un principe: les télomères, des capuchons situés à l'extrémité des chromosomes et servant à protéger l'information génétique, s'érodent à chaque division cellulaire. Dès qu'ils deviennent trop courts, ils signalent à la cellule qu'elle doit arrêter de se diviser et empêchent ainsi la dégradation de son ADN. Mise au repos, la cellule entre alors en sénescence.
Pour que ce modèle soit valide, l'inactivation d'un seul télomère devait être suffisante pour déclencher le programme de sénescence. En réalité, le laboratoire de Francis Rodier et bien d'autres scientifiques avaient déjà remarqué que plusieurs télomères dysfonctionnels étaient nécessaires à l'amorce de la sénescence.
"Le plus surprenant, c'est qu'avant d'entrer vraiment en sénescence les cellules se divisent une dernière fois. En fait, l'arrêt de la division cellulaire causé par le dysfonctionnement du télomère est si instable qu'il finit par créer des anomalies génétiques. Les cellules sénescentes ont, contrairement à ce qu'on pensait, un génome anormal. C'est ce que nous montrons aussi dans notre étude", dit le chercheur.
Instantanés de la vie d'une cellule

Francis Rodier
"Génétiquement, nous avons pu reproduire en laboratoire le phénomène de vieillissement cellulaire et faire en sorte que tous les télomères d'une population de cellules deviennent dysfonctionnels. Grâce à notre équipement, nous avons ensuite observé en temps réel ce qui se passait à l'intérieur de chaque cellule", explique le doctorant Marc-Alexandre Olivier, copremier auteur de l'étude avec son ex-collègue Sabrina Ghadaouia, actuellement au postdoctorat en Angleterre.
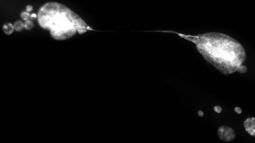
Le ballet de deux cellules vieillissantes entourées de micronoyaux et retenues par un pont chromosomique qui les unit dans la sénescence. Crédit: CRCHUM, 2021
Par exemple, pourrions-nous réparer les télomères avant la phase de sénescence et ainsi prévenir le vieillissement cellulaire et l'instabilité génomique ? Le milieu scientifique débat depuis quelques années de ce potentiel rajeunissement cellulaire. Néanmoins, ces approches thérapeutiques émergentes restent encore à raffiner.