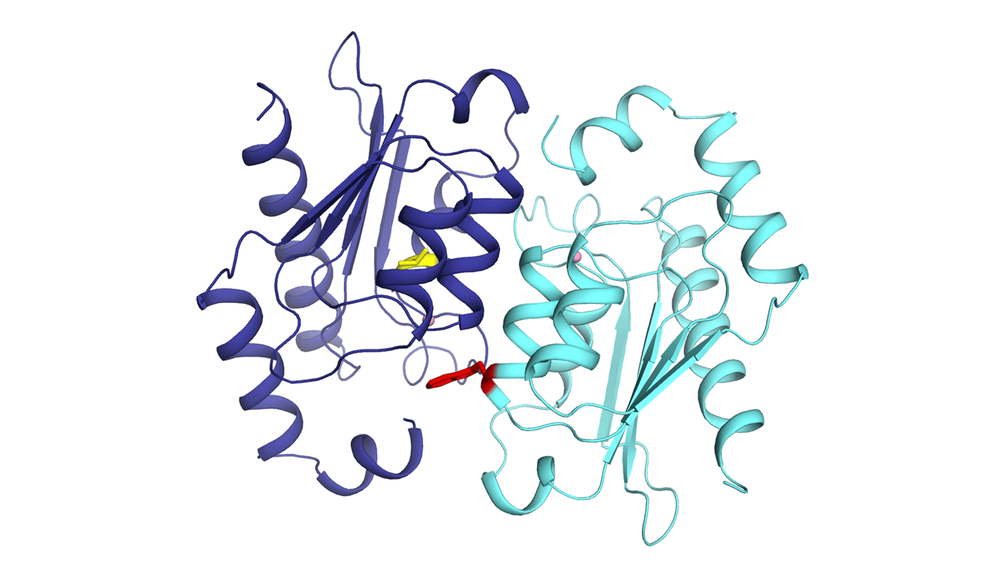
Dos copias de una proteína de la levadura de panadería en una relación de codependencia. Las mutaciones de pérdida de función (en amarillo y rojo) les impiden funcionar sin trabajar en conjunto.
Philippe Després
Para una misma función celular, la máquina proteica en los humanos a menudo tiene más componentes que en una bacteria. "Podríamos pensar que estos componentes fueron añadidos por selección natural, que la complejidad adicional tiene una utilidad o mejora el rendimiento en los humanos. Pero no necesariamente es así. La máquina de la bacteria suele ser más eficiente, incluso con menos componentes", subraya Philippe Després.
Aunque la adición de complejidad no causa un impacto negativo inmediato en la eficacia, los componentes adicionales deben ser fabricados, lo que requiere más energía. Por lo tanto, la máquina es más difícil de mantener, según el joven investigador, quien realizó su tesis bajo la dirección del profesor Christian Landry.
Una relación "tóxica"
Si no hay un valor añadido, ¿qué mecanismos explican la complejidad de las máquinas proteicas en los humanos? Un modelo teórico propuesto hace unas dos décadas sugiere que las mutaciones aleatorias podrían ser las responsables.
"En algún momento durante la evolución, el gen que codifica una de las proteínas de la máquina se duplicó y luego sufrió mutaciones de pérdida de función. Las nuevas proteínas codificadas por estos genes mutados desarrollarían una relación de codependencia, una relación tóxica. En otras palabras, las dos copias de proteínas deben ensamblarse para realizar la misma función que antes hacía una única copia ancestral", explica Philippe Després.
Según el joven investigador, esta teoría podría explicar la tendencia de los ensamblajes proteicos en los humanos a volverse cada vez más grandes con el tiempo. "Este mecanismo aleatorio actúa un poco en contra de la selección natural", añade.
Una prueba de concepto
Este modelo teórico de complejidad nunca había sido demostrado en el laboratorio hasta ahora. Para lograrlo, el equipo utilizó una proteína de la levadura de panadería como modelo. Los investigadores la sometieron a un proceso de mutaciones y observaron que varias combinaciones conducían a la codependencia y a la mayor complejidad.
Menos del 1% de las combinaciones desarrollaron una relación de codependencia para funcionar, un porcentaje más alto de lo que el equipo esperaba. "Parece poco", admite el investigador. "Pero en la escala de tiempo de la evolución, esto ofrece muchas oportunidades para que ocurran eventos de complejización. El proceso podría ser aún más común de lo que pensamos."
La idea de la codependencia en las máquinas proteicas podría tener implicaciones importantes para la investigación del cáncer. "En las células cancerosas, las dos copias pueden mutar de manera independiente. Anteriormente, si había pérdidas de función en ambas copias, se suponía que el gen ya no era funcional. Ahora, hay que determinar si esas copias pueden ensamblarse y formar una máquina funcional de todas formas", explica Philippe Després, ahora becario postdoctoral en el Broad Institute en Boston y en la Universidad de Guelph, en Ontario.
El "plato fuerte", según el investigador, fue analizar la estructura molecular de las proteínas a nivel atómico. "Es una resolución sin precedentes para estudiar cómo se ensamblan las dos proteínas para funcionar a pesar de las mutaciones de pérdida de función". Destaca la colaboración del equipo del profesor Rong Shi del Departamento de Bioquímica, Microbiología y Bioinformática de la Universidad Laval.
Los otros firmantes del estudio publicado en la revista Science son Alexandre K. Dubé, Marie-Ève Picard, Jordan Grenier, Rong Shi y Christian Landry.