Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
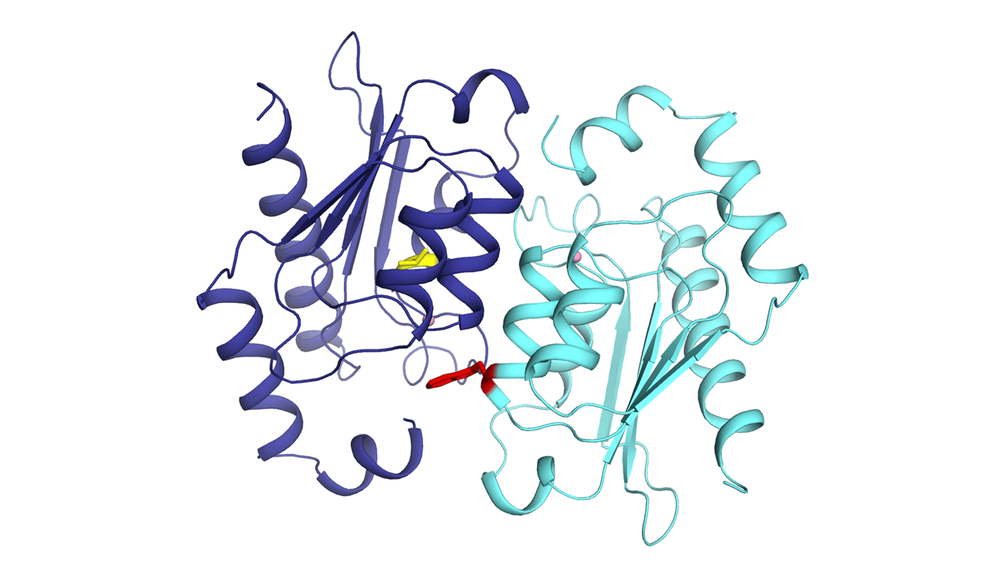
Deux copies d'une protéine de levure de boulanger prises dans une relation de codépendance. Des mutations de perte de fonction (en jaune et en rouge) les rendent incapables de fonctionner sans travailler ensemble.
Philippe Després
Pour une même fonction cellulaire, la machine protéique chez l'humain comporte souvent plus de composants que celle de la bactérie. "On serait porté à croire que ces composants ont été ajoutés par la sélection naturelle, que la complexification a une utilité ou qu'elle améliore la performance chez l'humain. Mais ce n'est pas nécessairement le cas. La machine de la bactérie est souvent plus performante, même avec moins de composants", souligne Philippe Després.
Même si la complexification n'a pas d'effet néfaste immédiat sur l'efficacité, les composants ajoutés doivent être fabriqués, ce qui demande plus d'énergie. La machine est donc plus difficile à maintenir, selon le jeune chercheur, qui a fait sa thèse sous la direction du professeur Christian Landry.
Une relation "toxique"
S'il n'y a pas de valeur ajoutée, quels mécanismes expliquent la complexification de la machine protéique chez l'humain ? Un modèle théorique datant d'une vingtaine d'années suggère que les mutations aléatoires seraient en cause.
"À un moment dans l'évolution, le gène qui encode une des protéines de la machine serait dupliqué, puis subirait des mutations de perte de fonction. Les nouvelles protéines encodées par ces gènes mutés développeraient une relation de codépendance, une relation toxique. Autrement dit, les deux copies de protéines doivent s'assembler pour accomplir la même fonction que l'unique copie ancestrale", explique Philippe Després.
Selon le jeune chercheur, cette théorie pourrait expliquer la tendance des assemblages protéiques chez l'humain à devenir de plus en plus gros avec le temps. "Ce mécanisme aléatoire agit un peu contre la sélection naturelle", ajoute-t-il.
Une preuve de concept
Ce modèle théorique de complexification n'avait jamais été démontré en laboratoire jusqu'à maintenant. Pour y arriver, l'équipe a utilisé une protéine de la levure de boulanger comme modèle. Les chercheurs l'ont soumise au processus de mutations et ont observé que plusieurs combinaisons menaient à la codépendance et à la complexification.
Moins de 1% des combinaisons développaient une relation de codépendance pour fonctionner, un pourcentage plus élevé que ce que l'équipe attendait. "Ça paraît peu, admet le chercheur. Mais sur l'échelle de temps de l'évolution, ça donne beaucoup d'occasions pour des événements de complexification. Le processus est peut-être encore plus répandu qu'on le pense."
L'idée de codépendance dans les machines protéiques peut avoir des implications importantes pour la recherche sur les cancers. "Dans les cellules cancéreuses, les deux copies peuvent muter de manière indépendante. Avant, si on avait des pertes de fonction dans les deux copies, on pouvait supposer que le gène n'était plus fonctionnel. Maintenant, il faut déterminer si ces copies peuvent s'assembler pour donner une machine fonctionnelle quand même", explique Philippe Després, maintenant postdoctorant au Broad Institute à Boston et à l'Université de Guelph, en Ontario.
Le "clou du spectacle", selon le chercheur, c'est d'avoir analysé la structure moléculaire des protéines, à l'atome près. "C'est une résolution inédite pour étudier comment les deux protéines s'assemblent pour fonctionner malgré les mutations de perte de fonction." Il souligne la collaboration de l'équipe du professeur Rong Shi du Département de biochimie, de microbiologie et de bio-informatique de l'Université Laval.
Les autres signataires de l'étude publiée dans la revue Science sont Alexandre K. Dubé, Marie-Ève Picard, Jordan Grenier, Rong Shi et Christian Landry.