Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Situation de l'hippocampe en profondeur dans le cerveau humain. Illustraton: Wikimedia Commons
Bien que de nombreux progrès aient été réalisés concernant la compréhension des causes génétiques de la schizophrénie, les mécanismes cellulaires qui sous-tendent des symptômes spécifiques sont peu connus. La délétion génétique 22q11.2 (perte de matériel génétique sur le chromosome 22) est le facteur de risque le plus fort pour développer la schizophrénie. En utilisant un modèle de souris porteuse d'une délétion génétique similaire obtenu par le laboratoire de Joseph Gogos à Columbia University (USA), l'équipe "Plasticité Synaptique et Réseaux Neuronaux" de Rebecca Piskorowski et Vivien Chevaleyre au laboratoire de Physiologie cérébrale, a étudié une petite région de l'hippocampe, qui est une structure importante pour la formation de mémoires et dont l'activité est affectée au cours de la schizophrénie.
Les résultats révèlent des altérations spécifiques de la région CA2 de l'hippocampe, qui a été longtemps ignorée mais qui émerge comme importante pour la formation de mémoires sociales au travers d'études récentes. En particulier, des changements ont été observés dans la balance entre l'excitation et l'inhibition ainsi que des altérations des propriétés des neurones de CA2. Il en résulte une forte diminution de l'activité des neurones de cette région, ce qui sous-tend probablement le déficit de mémoire sociale aussi observé chez ces souris. De façon intéressante et en parallèle avec le développement des symptômes chez l'homme, ces changements ne sont pas observés sur de jeunes animaux mais apparaissent uniquement au début de l'âge adulte.
Cette étude représente une avancée significative concernant la compréhension des mécanismes cellulaires altérés au cours de la schizophrénie, mais aussi potentiellement au cours d'autres maladies psychiatriques dans lesquelles les interactions sociales sont également affectées. Les résultats révèlent un mécanisme potentiel pour le déficit de mémoire sociale et, étant données les caractéristiques de la région CA2, ils ouvrent la voie à des cibles thérapeutiques potentielles.
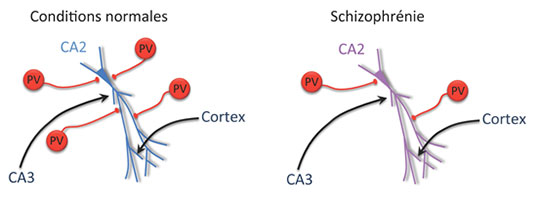
Figure: Dans des conditions normales, les neurones pyramidaux (cellules bleues) de la région CA2 sont fortement inhibés par des interneurones inhibiteurs exprimant la parvalbumine (PV, cellules rouges). Au cours de la schizophrénie, il y a une diminution du nombre d'interneurones exprimant la parvalbumine. Les cellules pyramidales deviennent aussi plus hyperpolarisées, probablement à cause d'un mécanisme compensateur qui préviendrait l'hyperexcitabilité de la région CA2 à la suite de la diminution de l'inhibition. En conséquence de cette hyperpolarisation, les cellules pyramidales de CA2 sont moins facilement activées par les afférences excitatrices (noires) venant de CA3 ou du cortex. Cette diminution de l'activité des neurones pyramidaux de CA2 est proposée comme étant la cause du déficit de mémoire sociale observé sur le modèle murin de schizophrénie.
© Vivien Chevaleyre
Pour plus d'information voir:
Age-Dependent Specific Changes in Area CA2 of the Hippocampus and Social Memory Deficit in a Mouse Model of the 22q11.2 Deletion Syndrome.
Piskorowski RA, Nasrallah K, Diamantopoulou A, Mukai J, Hassan SI, Siegelbaum SA, Gogos JA,Chevaleyre V.
Neuron. 2016 Jan 6;89(1):163-76. doi: 10.1016/j.neuron.2015.11.036.