Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
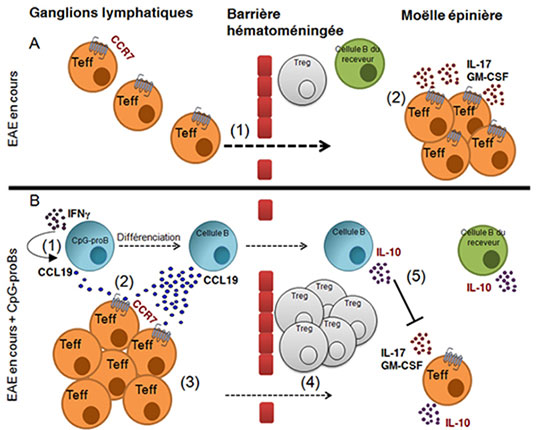
Figure: A: Lors de l'apparition des signes cliniques de l'Encéphalite Autoimmune Expérimentale (EAE), des cellules T effectrices (Teff) sont déjà dans la moelle épinière et y relarguent les cytokines pathogènes IL-17 et GM-CSF. B: Les CpG-proBs injectés à l'apparition des signes cliniques migrent vers les ganglions lymphatiques drainants où ils se différencient en cellules B transitionnelles libérant la chimiokine CCL19 sous le contrôle de l'IFN-gamma. CCL19 ancre les Teff dans les ganglions et en freine la migration vers la moelle épinière . Les CpG-proBs migrent aussi vers la moelle épinière où ils se différencient en cellules B qui produisent de l'IL-10 (B10). L'IL-10 inhibe la production par les Teff des cytokines pathogènes et induit l'expansion de Treg et de B10 du receveur. Les souris sont protégées de la paralysie.
© Flora Zavala. Nature publishing group.
Les maladies auto-immunes, comme le diabète de type 1 et la sclérose en plaques, résultent d'un dysfonctionnement du système immunitaire qui s'attaque aux tissus de l'organisme, en l'absence d'un contrôle efficace par les cellules régulatrices. Corriger le déséquilibre immunitaire à l'origine des maladies auto-immunes reste un défit majeur. Les thérapies cellulaires font jusqu'à présent majoritairement appel à des cellules complètement différenciées comme les cellules T ou B régulatrices. Elles sont rarement efficaces contre une maladie déjà déclarée.
Les progéniteurs hématopoïétiques immatures de la moelle osseuse, qui sont à l'origine des cellules du sang et du système immunitaire, perçoivent les signaux inflammatoires et infectieux touchant l'organisme. Les chercheurs ont fait l'hypothèse que ces progéniteurs activés pourraient jouer un rôle dans le contrôle des maladies auto-immunes.
Il s'est avéré que la stimulation in vivo et in vitro par une molécule d'oligonucléotide mimant une infection, agoniste du Toll-like récepteur-9 (TLR-9), induit l'émergence au sein de la moelle osseuse d'une population de progéniteurs de lymphocytes B doués de remarquables propriétés immunorégulatrices. Déjà montrés efficaces dans un modèle de diabète de type 1 (Montandon et coll., PNAS 2013), ces progéniteurs ont été maintenant évalués dans un modèle de sclérose en plaques. Après isolement et greffe lors de l'apparition des signes cliniques, ces progéniteurs ont diminué significativement et de façon durable la sévérité de la maladie. Une injection de seulement 60 000 progéniteurs par receveur suffit, alors que les cellules T ou B régulatrices doivent être injectées par millions pour exercer une protection et n'ont pas d'effet durable dans ces mêmes conditions. Après leur transfert adoptif, ces progéniteurs prolifèrent et migrent vers les sites où se développe la réponse auto-immune ("le lieu du crime") qui sont les ganglions drainants et la moelle épinière. Là, ils se différencient en cellules B matures et régulatrices, un processus indispensable pour une protection durable contre la maladie avec une unique injection de progéniteurs. Ces cellules B matures issues des progéniteurs greffés sont des populations à des stades distincts de différenciation et complémentaires par leurs mécanismes moléculaires. Ainsi, dans les ganglions, ils libèrent la chimiokine CCL19 qui y ancre les cellules T pathogènes à distance du système nerveux central, alors que dans la moelle épinière ils libèrent l'IL-10, une cytokine anti-inflammatoire qui éteint l'inflammation induite par les cellules encéphalitogènes déjà parvenues dans ce tissu et stimule l'émergence de cellules T et B régulatrices issues du receveur.
Ces travaux ouvrent la voie à une nouvelle thérapie cellulaire chez le patient, à partir des cellules de sa moelle osseuse. Ils ont été soutenus par l'INSERM, le CNRS, l'Université Paris Descartes ainsi que par l'ARSEP et le DIM Biothérapies-Région Ile de France.