Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
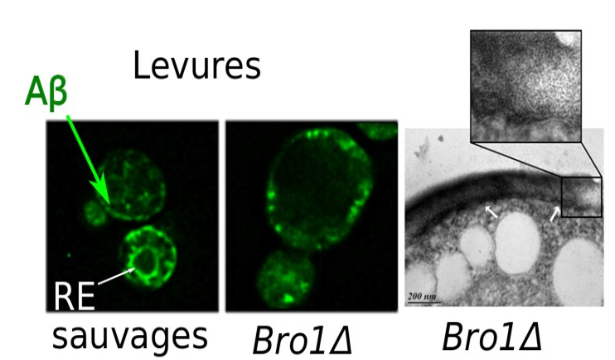
Figure: Dans des cellules de levure sauvages, Aß se retrouve dans les compartiments membranaires comme le réticulum endoplasmique. En absence du gène Bro1, Aß s'accumule sur la membrane plasmique et y provoque des défauts. Cette situation s'accompagne d'une augmentation drastique de la toxicité cellulaire. © Christophe Cullin.
La maladie d'Alzheimer est caractérisée par l'agrégation d'amyloïde bêta (Aß) à l'intérieur et à l'extérieur des neurones où il forme des plaques. La compréhension de l'action de ce peptide, ou petite protéine, constitue donc une étape cruciale dans l'étude de cette pathologie. Dans ce but, des scientifiques de l'Institut de chimie et de biologie des membranes et des nanoobjets (CBMN, CNRS/Université de Bordeaux/Bordeaux INP) et des Universités de Fribourg et de Louvain ont observé la toxicité d'Aß sur des modèles de levures. Le modèle choisi, S. cerevisiae, possède en effet un grand nombre de gènes en commun avec l'Homme.
Les chercheurs ont montré que les cellules pouvaient gérer l'accumulation d'Aß dans leur réticulum endoplasmique, une structure membranaire intermédiaire entre le noyau et la membrane externe. Ils ont ensuite testé le phénomène avec différentes souches de levures dont des gènes spécifiques ont été enlevés: certaines ne pouvaient plus compenser les dégâts causés par Aß (qui s'accumulait alors plutôt sur la membrane plasmique) et ont alors subi une augmentation drastique de la toxicité du peptide. Ce sont donc des problèmes d'expression des gènes protecteurs et réparateurs de la membrane plasmique qui influencent la toxicité cellulaire d'Aß. Le gène BRO1, dont l'équivalent humain est le gène Alix présent dans les plaques amyloïdes, est ainsi particulièrement important pour protéger les cellules. Maintenant qu'elles sont identifiées, les chercheurs peuvent à présent étudier ces interactions biochimiques dans l'espoir de les contrôler.
Références publication:
Gernot Fruhmann, Christelle Marchal, Hélène Vignaud, Mathias Verduyckt, Nicolas Talarek, Claudio De Virgilio, Joris Winderickx et Christophe Cullin
The impact of ESCRT-III on amyloid ß1-42 mediated membrane lesions in a humanized yeast model.
Frontiers in Molecular Neuroscience – Novembre 2018
DOI: 10.3389/fnmol.2018.00406
Contacts chercheur:
Christophe Cullin, CBMN UMR5248, Université de Bordeaux, Bordeaux INP