Décryptage d'une protéine fluorescente photo-commutable
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Les protéines fluorescentes photo-commutables sont utilisées comme marqueurs en biologie pour imager les cellules à une résolution allant jusqu'à quelques dizaines de nanomètres. A dessein, lesdites protéines sont successivement éteintes puis allumées par illumination alternée à deux longueurs d'ondes spécifiques de la lumière visible. Les commutations entre l'état non-fluorescent (off) et l'état fluorescent (on) sont très rapides et impliquent des passages dans des états excités qui se forment en quelques picosecondes (i.e. des millièmes de milliardièmes de seconde) qui ont été caractérisés structurellement récemment.
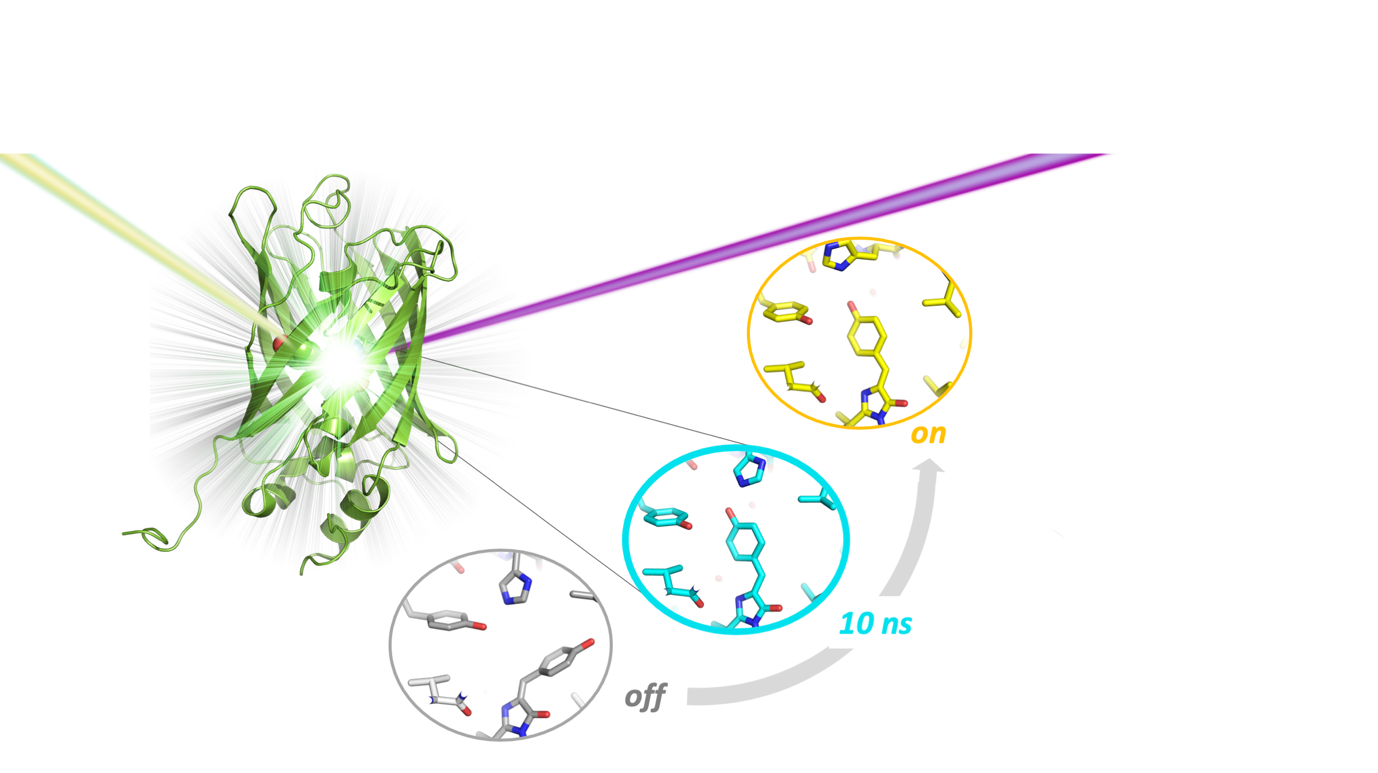
Structure d'un état intermédiaire d'une protéine fluorescente photo-commutable. La protéine fluorescente (verte) est excitée par un laser de lumière visible (rayon violet) et impactée par une impulsion de rayons X (rayon jaune) produite par un laser X à électrons libres. Dix nanosecondes après excitation de l'état de départ (off, gris), le coeur de la protéine adopte une structure intermédiaire (bleu), qui diffère de celle de l'état final (on, jaune). © CEA
Les changements conformationnels sur des échelles de temps plus lentes, cependant, restaient longtemps insaisissables, laissant ouverte la question du mécanisme photo-réactionnel dans les protéines fluorescentes réversiblement photo-commutables. Grace à une combinaison de cristallographie sérielle résolue en temps sur le laser X à électrons libres (XFEL) SACLA, au Japon, et de spectroscopie d'absorption transitoire, des chercheurs de l'Irig (IBS), de l'ILL et des Universités de Lille et de Rennes, en collaboration avec les Instituts Max-Planck de Heidelberg et de Göttingen, ont pu clarifier ce mécanisme, apportant pour la première fois une vision structurale d'un état intermédiaire clef (i.e. de celui adopté 10 nanosecondes après photo-excitation de l'état off).
Ce travail tranche un débat long de 10 ans sur l'ordre des évènements réactionnels lors de la photocommutation de l'état off vers l'état on au sein des protéines fluorescentes réversiblement photo-commutables et devrait contribuer à leur optimisation rationnelle pour des applications diverses et toujours augmentées en imagerie du vivant.
Références:
Photoswitching mechanism of a fluorescent protein revealed by time-resolved serial femtosecond crystallography and transient absorption spectroscopy | Nature communications