Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

[/i]
Les enzymes fer-soufre (Fe-S) ont un énorme potentiel encore largement inexploité en biotechnologie. Elles sont essentielles pour la biosynthèse d'une grande variété de produits naturels de valeur, tels que les biocarburants, les antifongiques, antibactériens et anticancéreux. Malheureusement, la dépendance des enzymes Fe-S à l'égard de leur cofacteur limite souvent leur activité catalytique. Ce problème crée des goulots d'étranglement dans les voies de biosynthèse qui en dépendent. Pire encore, la plupart des enzymes Fe-S présentent une activité faible ou nulle en dehors de leur hôte d'origine, notamment lorsqu'elles sont exprimées dans un [i]organisme hétérologue, ce qui exclut leur production par de nombreuses voies de biosynthèse. Dans le contexte de bio-ingénierie, ces obstacles sont en général surmontés. Cependant, même s'il est possible d'exprimer des enzymes hétérologues, il est difficile de garantir le maintien de leur activité. Ainsi, le potentiel des enzymes Fe-S ne peut être pleinement exploité que si nous sommes en mesure de les exprimer de façon routinière sous forme active au sein d'espèces hétérologues.
Des chercheurs de l'Irig [collaboration], ont étudié de façon systématique chez Escherichia coli la compatibilité des machineries procaryotes d'assemblages des clusters Fe-S (Figure) avec des enzymes Fe-S non-natives, par des approches de bioinformatique, de phylogénie, de microbiologie à grande échelle et de biochimie. Ils se sont intéressés à plusieurs enzymes Fe-S impliquées dans des voies métaboliques de synthèse de composés naturels valorisables (vitamine, biocarburant, antibiotique).
Cette étude systématique a permis d'identifier plusieurs facteurs affectant l'activité des enzymes Fe-S hétérologues: la sensibilité à l'oxygène, l'incompatibilité avec la machinerie de biogenèse des clusters Fe-S de l'hôte et l'incompatibilité avec les protéines de transfert d'électrons de l'hôte. En utilisant des collections d'orthologues d'enzymes Fe-S représentatives de l'ensemble de la diversité procaryote, les chercheurs ont découvert une corrélation frappante entre la distance phylogénétique et la probabilité qu'aura une protéine Fe-S à être exprimée de façon fonctionnelle. Ils ont également trouvé que l'expression conjointe d'une voie de biogenèse des Fe-S hétérologues augmente l'éventail phylogénétique des orthologues qui peuvent être supportés par l'hôte étranger. Enfin, ils ont constaté que les enzymes Fe-S qui nécessitent des protéines de transfert d'électrons spécifiques pour être actives sont rarement exprimées de manière fonctionnelle à moins que leurs partenaires réducteurs spécifiques ne soient identifiés et co-exprimés.
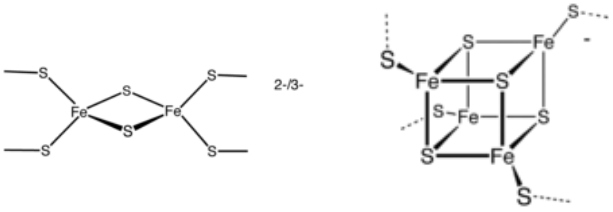
Deux exemples de clusters Fe-S.
Clusters 2[Fe-2S] et [4Fe-4S].
Les chercheurs ont appliqué ces principes pour améliorer l'activité d'une enzyme Fe-S de la bactérie Streptomyces, impliquée dans la voie de biosynthèse d'un antibiotique, quand celle-ci est exprimée dans Escherichia coli. Ils ont notamment identifié une protéine de transfert d'électron spécifique permettant d'augmenter l'activité de l'enzyme Fe-S d'un facteur 10, et les bases moléculaires de cette spécificité ont été identifiées.
L'ensemble de ce travail clarifie la façon dont la sensibilité à l'oxygène et les incompatibilités avec les machineries étrangères d'assemblage des centres Fe-S et de transfert d'électrons entravent les activités de protéines Fe-S hétérologues. Il montre combien l'identification de protéines de transfert d'électrons compatibles et de voies de biogenèse Fe-S hétérologues s'avère essentielle pour l'ingénierie de voies métaboliques fonctionnelles dépendantes d'enzymes Fe-S.
Notes:
- Un cofacteur est un composé chimique non protéique qui est nécessaire à l'activité biologique d'une protéine. Lorsque cette protéine est une enzyme, le cofacteur intervient dans la réaction catalytique.
- Les clusters fer-soufre (Fe-S) sont des cofacteurs inorganiques composés d'atomes de fer et de soufre (Figure). Ils sont présents au sein des protéines auxquelles ils confèrent de nombreuses fonctions biologiques telles que le transfert d'électron, la régulation de l'expression des gènes, la catalyse,... Les clusters Fe-S sont construits et distribués aux protéines et enzymes Fe-S via des machineries multiprotéiques complexes. Les composants essentiels de ces machineries sont largement conservés et très polyvalents.
- Organisme hétérologue: organisme utilisé pour produire une protéine mais qui ne correspond pas à l'organisme d'origine.
- Orthologue. Gène (ou protéine) commun à différentes espèces, provenant d'un même gène ancestral et ayant conservé une structure et une fonction identiques au cours de l'évolution.
Références:
D'Angelo F, Fernández-Fueyo E, Garcia PS, Shomar H, Pelosse M, Manuel RR, Büke F, Liu S, van den Broek N, Duraffourg N, de Ram C, Pabst M, Bouveret E, Gribaldo S, Py B, Ollagnier de Choudens S, Barras F and Bokinsky G
Cellular assays identify barriers impeding iron-sulfur enzyme activity in a non-native prokaryotic host.
eLife, 2022.