Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
L'un des principes fondamentaux du monde vivant est sa capacité à réaliser de manière extrêmement rapide et précise des réactions chimiques d'une grande complexité et de les enchaîner. C'est ainsi que les cellules perdurent et se divisent. Des macromolécules spécifiques, les enzymes, en quantités infimes par rapport aux réactants, ont le rôle de catalyser ces réactions biochimiques et peuvent être réutilisés un nombre incalculable de fois. Mais comment ces protéines essentielles à la vie peuvent-elles accélérer les réactions aussi efficacement ? En fait, le substrat doit d'abord être reconnu par l'enzyme, entrer en contact avec certains groupes chimiques qui lui sont propres, puis subir une transformation, favorisée par l'environnement chimique ainsi constitué et associée à des déformations de groupements moléculaires physiquement rapprochés dans l'espace. L'ensemble atteint ainsi un état éphémère très réactionnel appelé "état de transition", qui augmente la rapidité de la réaction biochimique de plusieurs centaines de milliards de fois.
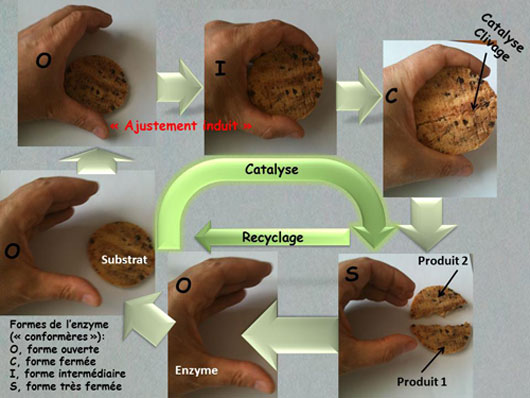
Une enzyme est capable de changer de conformation selon l'état d'avancement de la réaction chimique qu'elle catalyse. La première modification morphologique de la macromolécule (I) est induite par la fixation du substrat dans une poche bien spécifique de l'enzyme initialement ouverte (O). Cette étape, au cours de laquelle l'enzyme se referme progressivement autour du composé, permet la formation d'une liaison hydrogène qui stabilise alors le complexe dans un état particulièrement réactif (C). Enfin, lorsque l'enzyme a hydrolysé le substrat (S) et libéré les produits de cette réaction, elle retrouve sa forme ouverte de départ, prête à accueillir un nouveau composé.
© ISV, T. Meinnel, C. Giglione
Ces connaissances fondamentales inspirent les chercheurs pour identifier et améliorer des petits composés qui miment les substrats, sans subir de modifications mais restant tout de même longtemps fixés à l'enzyme. Cette rémanence rend en effet la macromolécule inactive et incapable d'exercer son activité sur son substrat naturel. Les médicaments opèrent exactement sur le même principe: ils correspondent le plus souvent à des inhibiteurs qui miment l'état de transition et "collent" littéralement à l'enzyme cible, l'empêchant de fonctionner et d'induire des pathologies associées. Les bases de la reconnaissance entre l'enzyme et son substrat (ou inhibiteur) sont cependant longtemps restées incomprises.
D'après les travaux du chimiste Emil Ficher en 1894 , l'enzyme reconnaît son substrat, selon un mécanisme de "clé-serrure". Restait alors à comprendre quand et comment les modifications morphologiques dites "conformationnelles" de l'enzyme interviennent et par quel processus ces modifications de forme sont réalisées. En 1958, Daniel Koshland a proposé un premier modèle , qui suppose que le petit composé interagit d'abord avec l'enzyme et que c'est cette interaction qui induit le changement conformationnel de la macromolécule, la rendant alors apte à effectuer la transformation du substrat. Selon ce modèle "d'ajustement induit", le substrat joue donc un rôle très actif dans la modification de la forme de l'enzyme. Dans le modèle alternatif "de l'équilibre conformationnel", formalisé dans les années 1990 (3,4), il est suggéré que l'enzyme peut exister sous plusieurs - au moins deux - isoformes conformationnelles et que le substrat se fixe préférentiellement à l'une des formes mineures qui est la seule adaptée à la catalyse. Dans ce mécanisme, le changement de conformation est préalable à la réaction et le substrat n'y contribue pas directement, au contraire du premier modèle.
Ces dernières années, de nombreuses données se sont accumulées pour privilégier ce second mécanisme, tandis que le premier est resté hypothétique, sans preuve expérimentale tangible de son existence. Pourtant, les récents travaux de l'équipe dirigée par Carmela Giglione Meinnel à l'ISV et menés en association avec Isabelle Artaud du LCBPT, Michel Desmadril de l'IBBMC et Frédéric Dardel du LRCB, viennent pour la première fois appuyer l'existence du modèle proposé par Koshland il y a plus de 50 ans. En utilisant une enzyme cible thérapeutique, les chercheurs ont tiré profit de l'étude détaillée d'un petit composé mimant le substrat, capable de se lier de manière très forte à l'enzyme, de bloquer son activité et d'exhiber ainsi des vertus antibiotiques, anticancéreuses et herbicides. La fixation efficace de ce composé à l'enzyme cible telle qu'elle est révélée par une série d'analyses de biologie structurale, d'enzymologie, de biophysique et de modélisation informatique, nécessite une étape "d'ajustement induit". En d'autres termes, c'est le petit composé qui, une fois lié à l'enzyme, induit sa modification de conformation.
Grâce à la résolution de la structure fine de cette enzyme issue du chloroplaste de la plante Arabidopsis thaliana dans plusieurs états conformationnels séquentiels, les scientifiques sont parvenus à décrire précisément les interactions et conformations de chacun des partenaires, enzyme et substrat, à chaque étape de la réaction. Dans ce cadre, la modification d'une "poche" dans laquelle un des groupements du substrat s'engouffre, rend possible la formation d'une liaison hydrogène, stabilisant ainsi le complexe enzyme-substrat dans l'état de transition et le rendant très réactif pour réaliser efficacement la réaction enzymatique d'hydrolyse. Les chercheurs ont tiré de leur étude toute une série de preuves indiquant que ce modèle s'applique à toutes les formes de l'enzyme, en particulier celles retrouvées chez les bactéries, cibles d'antibiotiques puissants. Ils apportent également une réponse à la compréhension du mécanisme par lequel une molécule thérapeutique peut se lier à sa cible de manière telle qu'elle n'arrive plus à s'en "décoller", ce qui permet de prolonger l'effet du médicament au-delà du traitement.
Ainsi, ce travail de recherche s'appuie sur la compréhension détaillée d'un mécanisme thérapeutique pour répondre à une question fondamentale et réciproquement, cette maîtrise conceptuelle pourra avoir en retour des conséquences en biologie appliquée et en thérapeutique. Mais comme le démontrent ces travaux, les stratégies adoptées par ces extraordinaires catalyseurs biologiques que sont les enzymes sont multiples et plastiques, pouvant également être complétées par une sélection conformationnelle. Ces éléments sont importants à prendre en considération dès lors que l'on souhaite concevoir ab initio ou améliorer les propriétés pharmacologiques de candidats médicaments.
Référence:
Trapping conformational states along ligand-binding dynamics of peptides deformylase: the impact of induced fit on enzyme catalysis, Sonia Fieulaine, Adrien Boularot, Isabelle Artaud, Michel Desmadril, Frédéric Dardel, Thierry Meinnel, Carmela Giglione, PLoS Biology, Published ahead on print May 24, 2011, doi:10.1371/journal.pbio.1001066