Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
© Dr_Microbe
Pseudomonas aeruginosa (Pa) est une bactérie à Gram négatif considérée comme pathogène opportuniste, principalement retrouvée chez les patients immunodéprimés ou atteints de mucoviscidose. Pa est une cause majeure d'infections nosocomiales à l'origine de pathologies pulmonaires et urinaires, mais est également fréquemment isolée à partir du sang de patients atteints de bactériémies. Les infections sanguines causées par ce pathogène sont particulièrement mortelles par rapport aux septicémies associées à d'autres espèces bactériennes. Une fois entré dans la circulation, Pa doit faire face au système immunitaire inné du sang. Cependant les stratégies employées par ce pathogène afin de résister au système du complément et aux cellules phagocytaires n'ont jamais été étudiées dans le sang total.
Grâce à l'étude de la survie d'une collection de six souches de Pa dans le sang total humain, des chercheurs de l'Irig ont montré que la résistance à l'activité microbicide du complément constitue le principal moteur de la survie bactérienne. Les chercheurs ont également découvert que les bactéries sensibles au complément étaient capables d'éviter une éradication totale, grâce à la formation d'une sous-population dite "evaders" résistante à l'action lytique du complément. Suivant la souche étudiée, ces "evaders" représentent entre 0,0001 et 0,01 % de la population initiale. Ces cellules rares ont également été observées dans d'autres bactéries pathogènes opportunistes comme Acinetobacter baumannii, Burkholderia multivorans, Escherichia coli, Klebsiella pneumoniae et Yersinia enterocolitica. Bien que génétiquement identiques au reste de la population sensible au complément, ces "evaders" développent une nouvelle stratégie leur permettant de perdurer dans le sang et ainsi de disséminer dans l'organisme, notamment en l'absence de traitements antibiotiques efficaces.
Les chercheurs ont de plus été en mesure d'identifier de nouveaux facteurs bactériens impliqués dans l'interaction entre Pa et le système du complément. Ils ont observé que des bactéries incapables de synthétiser certaines molécules essentielles comme la biotine (une vitamine) et les purines (constituant de bases des acides nucléiques) survivent mieux dans le plasma que la souche parentale. Ils ont également identifié un ensemble contigu de trois gènes (un opéron) dont les produits sont prédits comme étant localisés à la membrane de Pa. La surexpression des protéines de cet opéron confère à la bactérie une survie accrue dans le plasma d'un facteur 1 000 par rapport à la souche sauvage, et induit une surproduction des alginates chez cette dernière, suggérant l'existence d'une interaction complexe entre la membrane bactérienne, la sécrétion d'exopolysacharides et l'action lytique du complément.
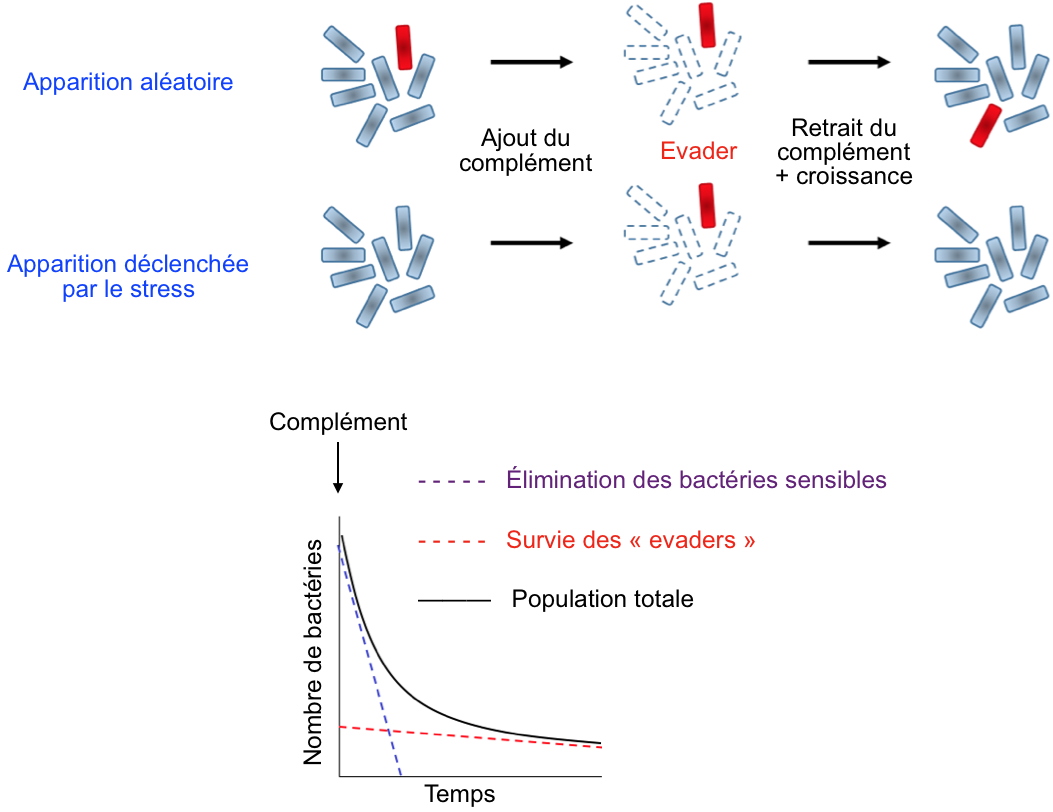
Deux mécanismes peuvent expliquer l'apparition des "evaders":
- mécanisme aléatoire: aléatoirement, les bactéries subissent des modifications épigénétiques/phénotypiques dont certaines les prédisposent à une résistance accrue au stress induit par le système du complément (bactérie rouge). Quand le stress est appliqué, toutes les bactéries sauf celles ayant acquis ce phénotype particulier, sont éliminées. Lorsque le stress est supprimé, ces variants phénotypes se divisent et génèrent une population identique à la population de départ composée majoritairement de bactéries sensibles et d'une faible proportion d'"evaders".
- mécanisme déclenchée par le stress: l'application du stress par le système du complément induit l'apparition de modifications phénotypiques conduisant à une résistance accrue à ce stress. Toutes les bactéries, sauf celles ayant acquis ce phénotype particulier, sont éliminées lorsque le stress est appliqué. Quand le stress est supprimé, ces variants phénotypes se divisent et génèrent une population identique à la population de départ, à savoir dépourvue d'"evaders".
Note:
Le système du complément est un mécanisme de défense composé d'environ 35 protéines et faisant partie de l'immunité innée. Il agit soit par lyse bactérienne directe, soit par opsonophagocytose (phagocytose augmentée par le dépôt de l'osponine C3b à la surface du pathogène puis prise en charge par des récepteurs spécialisés sur les cellules phagocytaires). L'action du complément contribue également à stimuler l'inflammation par production des protéines C3a et C5a.
Les alginates sont des polysaccharides et constituent un composant important des biofilms produits par certaines bactéries pour se protéger ; biofilms très résistants aux antibiotiques et aux globules blancs.
Collaboration avec l'Université Libre de Bruxelles, Department of Molecular Biology, Cellular & Molecular Microbiology, avec le Centre Hospitalier Universitaire Grenoble Alpes, Laboratoire de bactériologie-Hygiène hospitalière, et avec le laboratoire TIMC-Imag, Grenoble INP.
Références:
Pont S, Fraikin N, Caspar Y, Van Melderen L, Attrée I and Cretin F
Bacterial behavior in human blood reveals complement evaders with persister-like features.
PLOS Pathogens, 2020.