Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
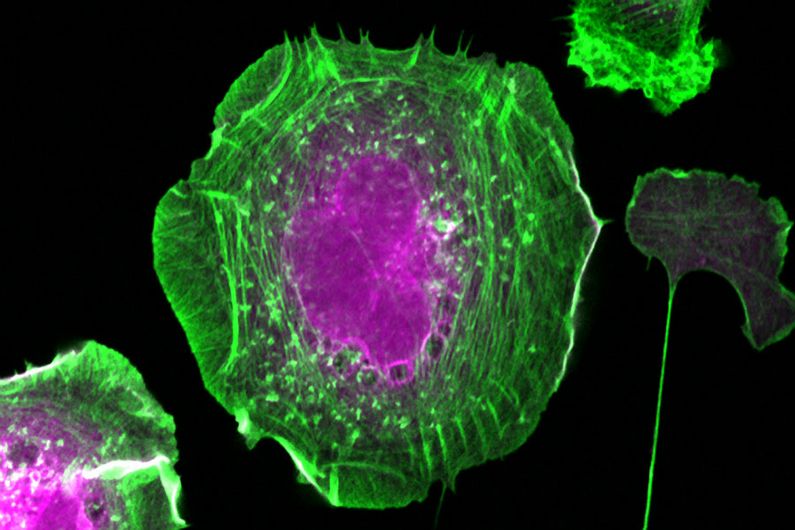
Filaments d'actine (en vert) et protéines biotinylées (en magenta) d'une cellule HeLa exprimant la sonde d'interaction de proximité BirA*-Flag-RAC1. Crédit: Amélie Robert (IRCM)
Dirigée par Jean-François Côté, biologiste cellulaire à l'UdeM, l'équipe a lancé 56 "appâts" dans des cellules humaines qu'elle incubait en laboratoire, capturant ainsi plus de 9000 protéines. Les résultats sont publiés dans la revue Nature Cell Biology.
L'objectif était de cibler les protéines qui s'attachent aux membres de la famille Rho. Ces protéines sont bien connues dans le monde de la biologie cellulaire depuis la découverte de leur influence dans l'agencement des morceaux du squelette cellulaire ‒ le cytosquelette ‒ au début des années 90.
Chez les humains, les 20 membres de la famille Rho sont dispersés sur la surface interne des membranes cellulaires et agissent comme de petits interrupteurs. Lorsqu'un signal provenant de l'extérieur ou de l'intérieur de la cellule les active, ils stimulent d'autres protéines et forcent le cytosquelette à ajouter des éléments à son architecture ou à en retirer.
De toutes ces protéines, seules trois à ce jour ont été étudiées minutieusement par les chercheurs: Cdc42, Rac1 et RhoA. La protéine Cdc42 agit comme un meneur et indique aux globules blancs le chemin qu'ils doivent emprunter pour trouver un site d'infection; Rac1, quant à elle, active les moteurs qui font avancer une cellule non musculaire; et RhoA stimule la formation de fibres qui permettent aux cellules de se contracter ou de constituer, en se rassemblant, des tissus résistants qui produisent, par exemple, la paroi d'un vaisseau sanguin.
Mais que font les autres protéines ? Et quelles sont celles avec lesquelles elles interagissent ? Pour le savoir, Jean-François Côté et son équipe sont partis à pêche.
Protéines à deux têtes
Dans les cellules humaines qui poussent dans les incubateurs de leur laboratoire, ils ont lancé leurs lignes appâtées, forçant ces cellules à produire des protéines à deux têtes, l'une contenant une seule protéine de la famille Rho et l'autre l'enzyme "biotine ligase". Cette dernière agit comme un tireur d'élite dans la cellule, attirant et marquant chaque protéine qui passe avec l'aide de son partenaire, un membre de la famille Rho. Chaque protéine qui s'approchait de l'appât était donc étiquetée avec de la biotine. Ensuite, M. Côté et son équipe ont dû déchiqueter les cellules pour désigner, une par une, chaque protéine marquée.
En utilisant 28 protéines à deux têtes et en présentant les GTPases ‒ une superfamille d'enzymes qui fonctionnent comme des "interrupteurs moléculaires" responsables de la régulation de nombreux processus cellulaires ‒ dans les configurations active et inactive, l'équipe a détecté un total de 9939 protéines. Certaines étaient déjà connues des scientifiques, y compris les activateurs et les désactivateurs des GTPases. Mais les chercheurs ont également découvert des centaines d'autres protéines individuelles dont le rôle reste à définir.
Ces découvertes constituent le chaînon manquant du processus impliquant la famille Rho mis au jour au début des années 90. À l'époque, les chercheurs avaient remarqué que la protéine RhoA active indirectement une autre protéine, l'ERM, et stabilise le cytosquelette. Mais ils ne connaissaient pas le mécanisme précis derrière ce processus. Lors de son "expédition de pêche", l'équipe de Jean-François Côté a trouvé la réponse: ce qui forge le lien entre RhoA et ERM est une protéine appelée SLK.
Dans son étude, l'équipe de l'IRCM s'est également penchée sur d'autres protéines qui, jusqu'à présent, étaient pratiquement inconnues des biologistes, à savoir GARRE et PLEKHG3. Les scientifiques ont démontré que ces protéines se lient naturellement aux formes actives de Rac1 et RhoG, respectivement. Il reste à comprendre la fonction exacte de ces associations. Pour accélérer les découvertes à ce sujet, l'équipe a dévoilé les caractéristiques d'autres molécules qu'elle a "attrapées" dans ses expériences ‒ donnant ainsi de la matière première à des dizaines de laboratoires dans le monde.
Les recherches de M. Côté et son équipe ont non seulement permis de défricher tout un secteur de la biologie cellulaire, mais elles ont aussi montré l'efficacité de cette méthode unique de "pêche". Jean-François Côté prévoit maintenant utiliser cette approche pour mieux comprendre le fonctionnement d'autres interrupteurs moléculaires, particulièrement ceux de la famille Ras, des protéines qui sont au centre de nombreux types de cancer.