Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Outre sa fonction universelle de ressource énergétique indispensable au métabolisme de tous les organismes vivants, l'adénosine triphosphate (ATP) est une molécule de signalisation critique, qui joue le rôle d'intermédiaire dans la communication entre les cellules. L'ATP active notamment les récepteurs-canaux de la famille P2X, qui contrôlent non-sélectivement le passage de cations (Na+, K+ et Ca²+) à travers la membrane plasmique de la cellule. La molécule se fixe en fait de manière réversible au récepteur et provoque un changement de conformation de la protéine qui le constitue, ce qui conduit à l'ouverture du canal ionique ancré dans la membrane.
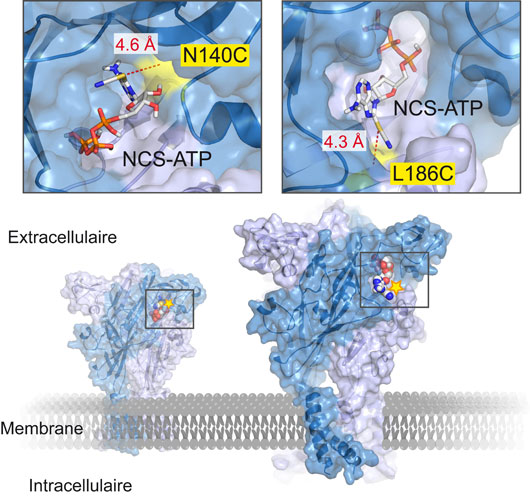
Figure: Mise en évidence des sites de liaison de l'ATP sur le récepteur-canal P2X2 inséré dans la membrane plasmique. La sonde agoniste 8-thiocyano-ATP (NCS-ATP) est un analogue structural de l'ATP qui possède un centre électrophile (NCS) réactif vis-à-vis des résidus cystéines. Elle se lie spécifiquement et selon deux modes de fixation dans le site ATP, localisé dans le domaine extracellulaire du récepteur, à l'interface entre deux sous-unités (en bleu et en mauve). La grande proximité spatiale (environ 4.5 Å) d'un acide aminé préalablement muté en résidu cystéine nucléophile (mutation N140C ou L186C, en jaune) avec le dérivé ATP électrophile (molécule modélisée par des bâtonnets colorés) entraîne une réaction chimique qui conduit à la formation d'une liaison covalente spécifique.
© LCAMB, T. Grutter.
Les récepteurs-canaux P2X sont impliqués dans les grandes fonctions physiologiques du vivant, telles que la transmission synaptique entre neurones, la réponse à l'inflammation ou la sensation de douleur. Parmi eux, on trouve le récepteur-canal P2X4. La récente résolution de sa structure cristallographique tridimensionnelle chez le poisson zèbre a permis de dévoiler l'architecture trimérique des récepteurs-canaux P2X. Cependant, malgré les efforts déployés par les scientifiques, les sites de liaison de l'ATP sur ces protéines membranaires n'avaient toujours pas été élucidés.
Résoudre cette énigme et identifier de manière définitive le site d'action de l'ATP sur les récepteurs de la famille P2X était notamment le challenge de l'équipe "Biophysicochimie des récepteurs-canaux", dirigée par Thomas Grutter au LCAMB. Pour cela, les chercheurs ont fait appel à une stratégie qui a déjà fait ses preuves sur d'autres types de récepteurs-canaux et l'ont appliquée au récepteur P2X2. Cette stratégie est basée sur la création d'une liaison covalente spécifique entre un dérivé de l'ATP rendu électrophile et un acide aminé du site de liaison rendu nucléophile. La réaction ne peut se faire que si la distance entre les réactifs est suffisamment petite (quelques Angstrom) et si le temps de résidence du ligand dans son site est suffisamment grand (bonne affinité du ligand pour le récepteur). En d'autres termes, le dérivé de l'ATP électrophile est utilisé comme "hameçon" moléculaire pour aller "pêcher" l'acide aminé nucléophile, qui se trouve à très grande proximité de l'hameçon lorsque le dérivé de l'ATP est positionné dans son site de liaison.
En collaboration avec Alexandre Specht de l'équipe "Chimie bioorganique" du LCAMB, les scientifiques ont donc synthétisé un analogue de l'ATP possédant un centre réactif électrophile vis-à-vis des résidus cystéines: le 8-thiocyano-ATP (NCS-ATP). Cette molécule a effectivement été identifiée comme un agoniste du récepteur P2X2 et possède une affinité apparente comparable à celle de l'ATP. Par ailleurs, les chercheurs ont réalisé par mutagenèse dirigée 26 mutations cystéine individuelles dans la poche supposée de l'ATP sur le récepteur et exprimé chacun de ces mutants dans des cellules humaines embryonnaires de rein (HEK). La fonctionnalité de ces mutants a pu être mesurée grâce à la technique d'électrophysiologie "patch-clamp", qui permet d'enregistrer les flux d'ions à travers le canal ionique lorsque celui-ci s'ouvre en réponse à la liaison du dérivé de l'ATP.
Vingt-trois des récepteurs mutants réalisés ont répondu à la liaison du NCS-ATP et deux d'entre eux en particuliers, N140C et L186C, ont réagi de façon irréversible et spécifique à cette sonde. Ceci démontre la grande proximité spatiale et l'interaction des résidus cystéine insérés en position 140 et 186 du récepteur P2X2 avec le dérivé de l'ATP. Par le biais de méthodes bioinformatiques appliquées in silico, les scientifiques ont confirmé les données expérimentalement obtenues et ont évalué la distance entre la fonction réactive du NCS-ATP et la cystéine introduite, soit en position 140 soit en position 186. Cette distance, comprise entre 4,3 et 4,6 Angstrom, est tout à fait compatible avec une réaction chimique.
Ces travaux ont donc permis de localiser de manière définitive les sites de liaison de l'ATP sur les récepteurs de la famille P2X et montrent que la molécule d'ATP adopte au moins deux modes de fixation sur son site, localisé dans le domaine extracellulaire des récepteurs, à l'interface entre deux sous-unités. Ils ouvrent la voie à la conception rationnelle de nouvelles molécules agissant plus efficacement sur les voies de la douleur.