Le coeur du virus de la rougeole dévoilé en trois dimensions par microscopie électronique
Publié par Adrien,
Source: CNRS-INSBAutres langues:
Source: CNRS-INSBAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
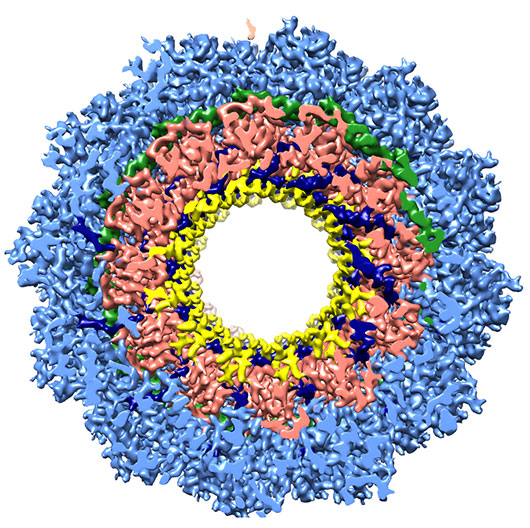
Figure 1: vue de dessus de la structure tridimensionnelle de la nucléocapside du virus de la rougeole résolue à 4.3 Å par cryo-microscopie électronique.
Le virus de la rougeole provoque une maladie très contagieuse chez l'homme. Malgré la disponibilité d'un vaccin efficace, ce virus qui est surtout présent dans les pays en voie de développement dans lesquels il infecte les enfants, a fait récemment plusieurs réapparitions en France.
Le virus de la rougeole est un virus enveloppé à ARN simple brin de polarité négative. Cette information génétique est protégée par une nucléoprotéine et encapsidée au sein de la particule virale. La nucléoprotéine de ce virus a été exprimée dans des cellules d'insecte et lors de cette expression, les protéines se sont associées aux ARN cellulaires pour former des pseudo-nucléocapsides mimant celles du virus de la rougeole.
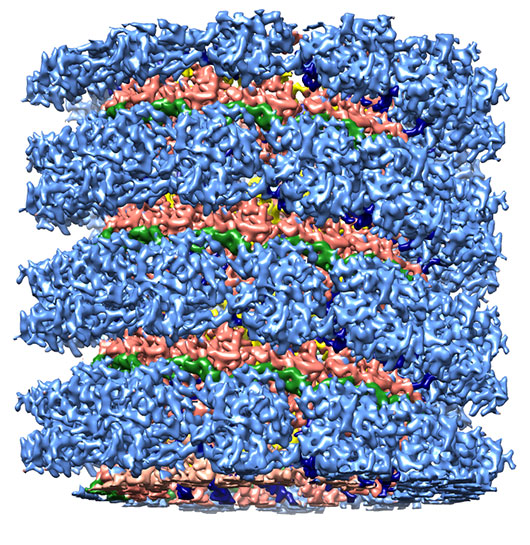
Figure 2: Vue de côté et légèrement inclinée de la structure tridimensionnelle de la nucléocapside du virus de la rougeole résolue à 4.3 Å par cryo-microscopie électronique.
Les différentes parties de la nucléoprotéine sont colorées comme suit dans les figures 1 et 2: Bras N-terminal (amino-acides 1-36): bleu foncé ; Partie N-terminale (36-264): bleu clair; Partie C-terminale (265-371): saumon ; Bras C-terminal (372-391): jaune; ARN monocaténaire: vert
© Grégory Effantin (IBS/ UJF)
Ces nucléocapsides, rigidifiées par une coupure à la trypsine, ont été visualisées en cryo-microscopie électronique dans leur état natif après congélation dans de l'éthane liquide grâce au microscope Polara de l'IBS. Les images obtenues sur films photographiques ont été analysées en collaboration avec l'EMBL à Heidelberg, et ont permis de recalculer la structure tridimensionnelle de ces nucléocapsides jusqu'à une résolution inégalée de 4.3 Å. Cette résolution permet de tracer la chaine polypeptidique de cette protéine en s'aidant des structures tridimensionnelles connues d'autres nucléoprotéines (bronchiolite, Nipah). Au niveau mondial, ceci représente la première détermination de la structure d'une nucléocapside hélicoïdale d'un virus à ARN négatif avec une résolution quasi atomique. Il est à noter en effet que les autres structures de nucléoprotéines connues ont été déterminées par cristallographie aux rayons X mais dans une conformation annulaire différente de la structure adoptée au sein du virus. Il s'agit également de la plus haute résolution obtenue actuellement avec le microscope électronique Polara de Grenoble. Avec l'installation d'une caméra à détection directe d'électrons, les résolutions atteintes sur ce microscope devraient encore augmenter.
L'analyse de cette structure a permis de mieux comprendre le mode de fixation de la nucléoprotéine à l'ARN pour cette famille de virus avec 6 bases par nucléoprotéine contrairement à la nucléoprotéine du virus de la bronchiolite qui en fixe 7. La nucléoprotéine a une forme de mâchoire qui enserre et protège l'ARN. Grâce à cette structure, les chercheurs ont pu également visualiser les interactions entre les différentes nucléoprotéines au sein de la nucléocapside hélicoïdale. Ces interactions se font par échange de domaines plus que par des interactions latérales, ce qui permet à l'hélice de rester flexible, qualité indispensable pour permettre la transcription de l'information génétique. Cette structure pourra être utilisée pour concevoir de manière rationnelle de nouvelles drogues antivirales.
Ces études ont bénéficié du soutien financier de FRISBI (ANR-10-INSB-05-02) et de GRAL (ANR-10-LABX-49-01) dans le cadre du partenariat pour la biologie structurale de Grenoble (PSB). Ce microscope ainsi que les autres de ISBG sont accessibles dans le cadre de l'infrastructure nationale FRISBI (French Infrastructure for Integrated Structural Biology).