Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
[/i]
L'utilisation de nanoparticules (NP) en milieux biologiques est très répandue, tant dans le secteur environnemental qu'agro-alimentaire ou pharmaceutique. En nanomédecine, par exemple, elles sont utilisées pour prévenir ou soigner certaines maladies, pour le diagnostic in vivo, le relargage ciblé de médicaments et l'imagerie moléculaire. Lorsqu'une NP est plongée dans un milieu biologique comme le sang ou le mucus, une couche de protéines, appelée "[i]corona", s'adsorbe instantanément à sa surface et lui confère une nouvelle identité biologique qui peut conditionner sa bio-distribution, voire sa toxicité. La formation de cette corona dépend directement de la forme, la taille ou la charge électrique des protéines et des NP.
Une équipe interdisciplinaire de scientifiques de l'UMR NIMBE, du
Laboratoire Léon Brillouin et de l'Institut de biologie intégrative de la cellule (I2BC - CNRS-CEA-Université de Paris Saclay-INRAE-INSERM) s'est penchée sur les interactions protéines/NP1, au moyen de diverses techniques: isothermes d'adsorption, calorimétrie par titrage isotherme, dichroïsme circulaire et cryomicroscopie électronique à transmission. Ils ont ainsi récemment, mis en évidence le rôle spécifique de la taille des protéines sur ces interactions:
En utilisant une série d'hémoprotéines de base structurale et fonction identiques, mais de taille largement variable (d'un facteur 1 à 144 !), ils ont pu mettre en évidence des mécanismes d'adsorption sur des particules de silice de taille fixe totalement distincts. Ainsi, les petites protéines s'adsorbent sur les NP par des mécanismes purement enthalpiques via la création de liaisons entre la protéine et la surface de la NP. A contrario, les grosses protéines, d'une taille comparable à celle des NP, interagissent par des mécanismes entropiques analogues à ceux qui gouvernent les phénomènes d'auto-assemblage des colloïdes. Ainsi, chaque protéine peut se lier directement à plusieurs NP et former des ponts dans ces nouveaux assemblages protéines/NP qui ont pu être directement observés pour la première fois par cryomicroscopie électronique.

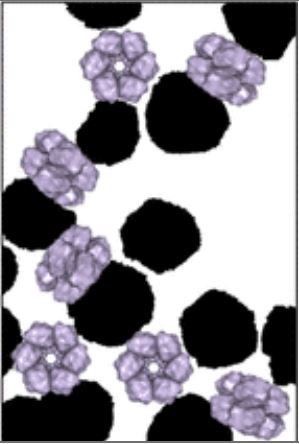
(A) Représentation à l'échelle des protéines et des nanoparticules (sphères de silice jaunes). Les protéines sont des hémoprotéines de tailles différentes: la myoglobine de cheval, l'hémoglobine de porc, de Riftia pachyptila et d'Arenicola marina
(B) image par cryo-TEM d'hémoglobines d'Arenicola marina en interaction avec les NP de silice. Echelle: 30 nm.
(C) schéma correspondant permettant d'identifier les différentes orientations des protéines.
© Laurent Marichal et al.
Ces observations, publiées dans la revue Langmuir, montrent qu'il est nécessaire d'aller au-delà du simple modèle de couronne pour comprendre comment les protéines affectent l'agrégation, et donc la distribution, des nanoparticules dans les organismes vivants et les milieux naturels.
Ces observations, publiées dans la revue Langmuir, montrent qu'il est ainsi nécessaire d'aller au-delà du simple modèle de couronne pour comprendre comment les protéines s'aggrègent autour des nanoparticules, facteur dont dépend la façon dont se distribuent les nanoparticules dans les organismes vivants et les milieux naturels.
Contact CEA-IRAMIS:
- Serge Pin et Jean-Philiipe Renault (NIMBE/LIONS)
- Fabrice Cousin et Sophie Combet (LLB UMR CEA-CNRS / MMB).
Références:
- From protein corona to colloidal self-assembly: the importance of protein size in protein-nanoparticle interactions,
L. Marichal, J. Degrouard, A. Gatin, N. Raffray, J.-C. Aude, Y. Boulard, S. Combet, F. Cousin, S. Hourdez, J. Mary, J.-P. Renault et S. Pin, Langmuir (2020) 36, 8218-8230.
Voir aussi le fait marquant 2019 NIMBE-LLB-I2BC:
"La couronne de protéines adsorbées sur des nanoparticules de silice dévoile sa structure" et la publication Langmuir associée:
- Protein−nanoparticle interactions: what are the protein−corona thickness and organization ?
L Marichal, G Giraudon-Colas, F Cousin, A Thill, J Labarre, Y Boulard, JC Aude, S Pin, JP Renault. Langmuir, 35 (2019) 10831.