Dichroïsme circulaire - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
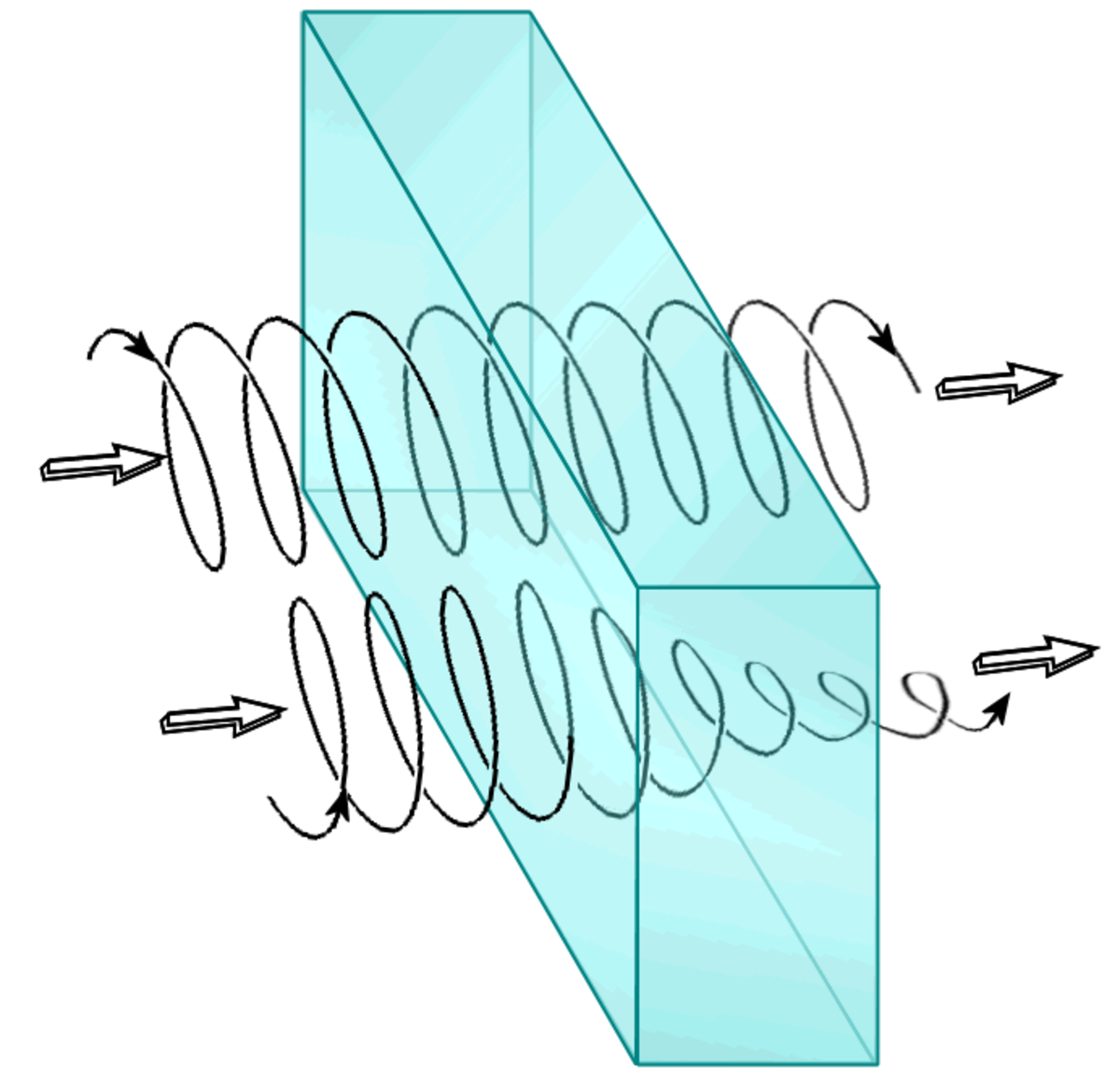
On dit qu'un matériau présente un dichroïsme circulaire s'il absorbe différemment la lumière selon que sa polarisation est circulaire droite ou circulaire gauche.
La polarisation de toute onde lumineuse peut se décomposer en deux parties : l'une circulaire droite (PCD) et l'autre circulaire gauche (PCG). En présence de dichroïsme circulaire, l'une des deux composantes sera absorbée plus rapidement que l'autre. Cette propriété se rencontre plutôt dans les liquides et les solutions du fait de la structure des molécules. On suppose que c'est le cas pour le reste de l'article.
Le phénomène est découvert par le physicien français Aimé Cotton en 1896.
Théorie
L'absorbance du milieu dichroïque présente deux valeurs, associées respectivement aux deux polarisations circulaires : AG et AD. On définit alors la différence entre ces deux absorbances :
-
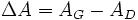
Cette grandeur dépend de la longueur d'onde, c'est-à-dire de la couleur de l'onde lumineuse utilisée.
On peut aussi exprimer l'égalité ci-dessus à l'aide de la loi de Beer-Lambert :
-
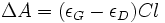
où
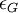
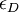
On définit alors le dichroïsme circulaire par :
-
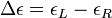
Cependant la grandeur mesurée n'est pas directement cette dernière. En effet, il est seulement possible de mesurer l'ellipticité θ grâce à des polariseurs. Cette ellipticité est un angle correspondant à la forme de la polarisation de la lumière : si la polarisation est rectiligne alors
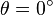
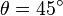
Pour relier l'ellipticité mesurée au dichroïsme circulaire, on a recours à une approximation très souvent vérifiée : on suppose que l'effet de ce dichroïsme est faible, c'est-à-dire
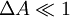
-
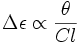
Et en définissant l'ellipticité molaire par :
-
![[\theta]=\frac{100\theta}{Cl}](https://static.techno-science.net/illustration/Definitions/autres/5/561247c32f15a63a5e8ef80028b676b1_793529c9e86bc76d8a549bcc75b876eb.png)
on obtient la relation directe entre la quantité mesurée et le dichroïsme circulaire :
-
![[\theta] = a \; \Delta\epsilon](https://static.techno-science.net/illustration/Definitions/autres/b/b7b2d4e22303a1890df2c5b0b7fab888_470afb75dc328cf31f874edfaaa4473e.png)
Limitations expérimentales
Le dichroïsme circulaire a été étudié chez les glucides, mais avec un succès limité du fait des bandes d'absorption de ces molécules qui se trouvent dans une région des ultraviolets (100-200nm) difficile d'accès.
Une autre difficulté réside dans le fait que les solutions tampon typiques absorbent souvent la lumière dans la gamme de pH favorable au dichroïsme circulaire. Ainsi, les tampons de phosphates, de sulfates, de carbonates et d'acétates sont souvent inutilisables. On préfère alors utiliser le borate et les sels d'ammonium. Quelques expérimentateurs ont remplacé, pour les mêmes raisons, les ions fluorure par les ions chlorure. Certains ont simplement travaillé avec de l'eau. Mais il est souvent nécessaire d'utiliser des cuves très fines pour limiter ces absorptions parasites. Des longueurs de 0.1 mm ne sont pas rares.
Les spectres de dichroïsme circulaire utilisés dans la détection de la structure secondaire sont liés à l'absorption entre les orbitales π et π* des liaisons peptidiques. Ces bandes d'absorption résident en partie dans la partie difficile d'accès des ultraviolets. Cette partie est inaccessible dans l'air à cause de la forte absorption de l'oxygène dans cette gamme de longueurs d'ondes. Dans la pratique, on réalise les mesures à l'aide d'instruments remplis d'azote, et sans oxygène.
Une fois que l'oxygène est éliminé, il faut optimiser le reste du système afin de limiter les pertes. Par exemple, les miroirs doivent être couverts d'aluminium, et optimisés pour la zone du spectre voulue (UV lointain).
La source habituelle de lumière dans ce type d'instruments est une lampe à décharge haute-pression à xénon. Ce type de lampes est inutilisable dans l'UV lointain. Il faut utiliser des lampes spécialement fabriquées avec des enveloppes de verre de quartz synthétique très pur. La lumière d'un synchrotron est encore plus intense dans ce domaine, et a été utilisée pour effectuer des mesures de dichroïsme circulaire jusqu'à des longueurs d'ondes de l'ordre de 160 nm.