Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
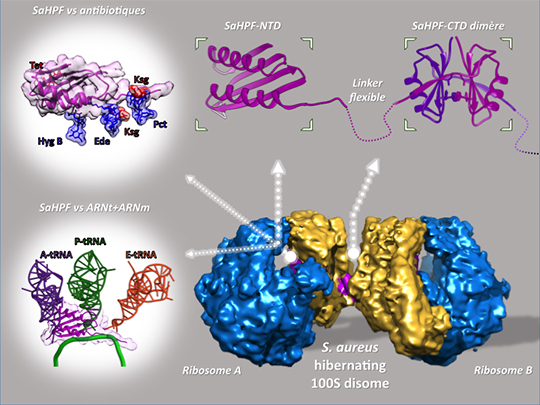
Figure: Structure du disome 100S en hibernation du staphylocoque doré. Structure par cryo-microscopie électronique (en bas à droite) du disome. Les flèches épaisses pointent en haut vers les parties correspondantes de SaHPF, la protéine spécifique responsable de cet assemblage en disome très particulier. Les flèches fines pointant vers la gauche soulignent le rôle de SaHPF dans l'arrêt du processus de la traduction ainsi que la protection contre les antibiotiques, en empêchant l'interaction des ribosomes avec les ARNm et les ARNt ainsi qu'avec différentes familles d'antibiotiques, respectivement.
©Yaser Hashem.
Grâce à un temps de génération relativement court de l'ordre de quelques dizaines de minutes, les bactéries bénéficient d'une capacité à évoluer beaucoup plus rapide que celle des mammifères. Cet avantage inné dans leur adaptation à l'environnement explique en partie l'émergence tôt ou tard de mécanismes de résistance ou de défense en réponse à de nombreux types de stress, tels qu'un appauvrissement en substances nutritives, un choc thermique, ou un traitement antibiotique. La mise en veille de la machinerie de synthèse des protéines par dimérisation est l'un de ces phénomènes.
Chez tous les organismes vivants, la synthèse des protéines est pilotée par les ribosomes. Chez les bactéries, il s'agit d'un assemblage de plus de 50 protéines avec trois longues chaînes d'acides ribonucléiques, pour une masse totale environ 100 fois supérieure à la taille moyenne d'une protéine. On sait depuis les travaux réalisés par le prix Nobel Jim Watson dans les années 50 que les ribosomes bactériens ont la capacité de s'associer en dimères au sein des bactéries. Des travaux plus récents ont montré que cet agencement des ribosomes deux-par-deux s'accompagne d'un arrêt de la synthèse des protéines, un peu comme une entreprise qui aurait temporairement suspendu son activité en attendant de meilleures conditions économiques. Ce phénomène appelé à juste titre "hibernation", est provoqué par l'expression de facteurs protéiques qui se lient au ribosome pour l'inactiver et provoquer sa dimérisation.
Les travaux dirigés par les équipes de Yaser Hashem et Marat Yusupov, en collaboration avec trois autres équipes dont deux russes, révèlent le rôle de ce facteur d'hibernation dans la dimérisation de ribosomes du staphylocoque doré. A la différence d'un nombre restreint de bactéries, comme par exemple le modèle d'étude classique Escherichia coli, Staphylococcus aureus possède un seul facteur d'hibernation, plus long, et dont seulement une partie est similaire à celle déjà bien caractérisée chez E. coli. Par cryomicroscopie électronique, les chercheurs ont obtenu la structure fine de dimères de ribosomes de S. aureus, grâce à la mise en présence de ribosomes isolés et du facteur d'hibernation surexprimé puis purifié.
L'examen de la structure à une résolution quasi-atomique, montre que chez S. aureus comme chez toutes les autres espèces de bactéries, la partie conservée du facteur d'hibernation empêche la fixation des autres partenaires nécessaires à la synthèse des protéines, comme le messager et les adaptateurs qui apportent les acides aminés.
L'aspect le plus étonnant de cette étude concerne la partie propre à S. aureus. Ce domaine, qui se replie en trois dimensions de façon indépendante, fait une saillie à la surface du ribosome, ce qui lui permet d'établir plusieurs interactions fortes avec son homologue sur un autre ribosome, générant ainsi cet arrangement de ribosomes en dimères. Il est à noter que des résultats similaires ont été obtenus par le groupe de Daniel Wilson à l'université de Munich, à partir de la bactérie Bacillus subtilis, elle aussi pourvue d'un facteur d'hibernation plus long que celui d'E. coli (Beckert et al., EMBO J. 2017 Jul 14;36:2061-2072).
Le staphylocoque doré étant parmi les premiers agents pathogènes responsables d'infections contractées en milieu hospitalier, toute particularité fonctionnelle et mécanistique ouvre la porte à la mise au point de thérapies ciblées et donc non-toxiques pour l'homme. Ainsi, sur la base de cette structure fine, il est envisageable de concevoir des agents thérapeutiques qui empêcheraient l'association des ribosomes et donc la survie de la bactérie en condition extrême. Toutefois, des travaux sont encore nécessaires pour déterminer précisément à quel stade du cycle de synthèse des protéines et sous quelles conditions de stress, ces facteurs d'hibernation se lient au ribosome, chez S. aureus mais aussi chez les bactéries non-pathogènes endogènes qui ont recours au même procédé. Ainsi, les réponses apportées aux questions relatives au mécanisme d'association puis de dissociation de ces dimères devraient permettre de mieux caractériser la spécificité de S. aureus en vue de proposer de meilleures solutions pour le combattre.