Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
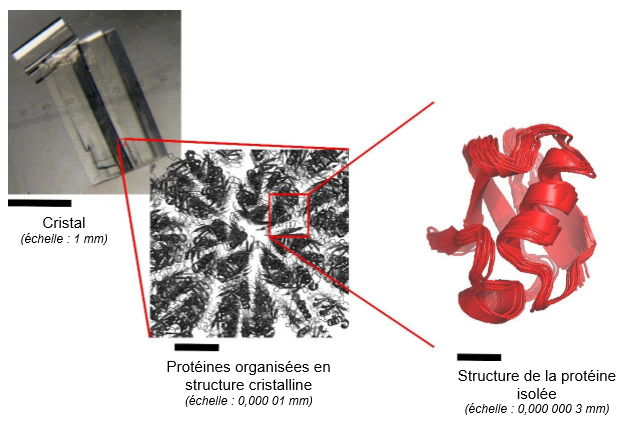
Figure: Observation d'un cristal de protéines, typiquement utilisé pour étudier la structure de cette molécule par cristallographie. A gauche: visualisation à l'œil nu ; au centre: modélisation de l'agencement des protéines en réseau cristallin ; à droite: représentation schématique du mouvement d'une protéine de quelques degrés au sein du cristal, tel qu'il est observé par spectroscopie RMN et simulation de dynamique moléculaire. À cause de ces mouvements la structure de la protéine que l'on peut obtenir par cristallographie devient "floue".
Illustration: © Paul Schanda / CEA
La cristallographie aux rayons X est la méthode la plus prolifique pour la détermination de structures de protéines. La qualité d'une structure cristallographique dépend du "degré d'ordre" dans le cristal. Les protéines mesurent en général quelques nanomètres. Plusieurs milliers de milliards de protéines doivent s'agencer parfaitement, et en trois dimensions, pour constituer un réseau cristallin bien ordonné. Cette étape est nécessaire pour permettre le succès d'une détermination structurale. Parfois, des cristaux pourtant macroscopiquement parfaits déçoivent une fois irradiés par les rayons X, frustrant ainsi la caractérisation structurale. Il a été proposé que des mouvements d'ensemble des protéines cristallisées puissent expliquer ce paradoxe. Mais cette supposée dynamique résiduelle lente n'a jamais été directement observée dans un cristal.
Les chercheurs de l'IBS ont utilisé une approche multi-technique, combinant la spectroscopie par RMN à l'état solide, les simulations de dynamique moléculaire, et la cristallographie aux rayons X. Grâce à la RMN du solide, ils ont mesuré la dynamique d'une protéine modèle, l'ubiquitine, dans trois de ses formes cristallines. Leurs résultats indiquent que même cristallisées, les protéines restent animées de légers mouvements résiduels. Ces mouvements sont d'autant moins amortis que le cristal est moins compact.
En concordance, les données cristallographiques collectées sur les trois types de cristaux indiquent que plus le cristal est compact, et mieux il diffracte – et donc mieux on peut déterminer la structure des protéines qui le compose. Pour reconstituer le mouvement des protéines dans ces réseaux cristallins, des simulations de dynamique moléculaire ont été réalisées pour chacune des trois formes cristallines. Ces simulations suggèrent qu'au sein des cristaux, les protéines tournent sur elles-mêmes de quelques degrés, à l'échelle de la microseconde. En accord avec les mesures de RMN, ces "balancements" sont d'autant plus marqués que le cristal est peu compact.
Cette étude contribue à mieux comprendre l'impact des mouvements moléculaires lents sur la qualité des structures cristallographiques, mais aussi plus généralement la dynamique des molécules à l'échelle atomique. Elle explique par ailleurs en partie pourquoi certains cristaux, quoique macroscopiquement "beaux", se révèlent vides d'information une fois étudiés par cristallographie.
Références: "Observing the overall rocking motion of a protein in a crystal”, Peixiang Ma et. al., Nature Communications, Octobre, DOI: 10.1038/NCOMMS9361