Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

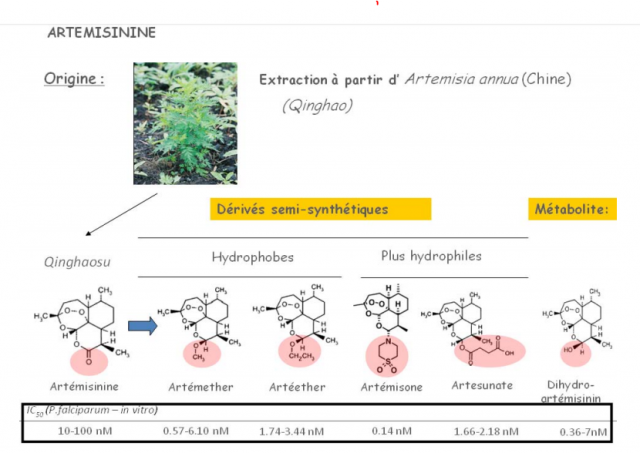
Artemisia annua (Chine) ©DR
Le paludisme est une cause de mortalité importante dans les pays du Sud. Il y a eu, en 2013, environ 200 millions de cas et un demi-million de décès. L'Afrique est particulièrement affectée puisqu'elle subit 90 % des décès. Aujourd'hui, l'un des médicaments les plus efficaces pour combattre le paludisme est l'artémisinine, molécule issue d'une plante trouvée en Chine. Sa découverte, par la professeure Youyou Tu, a été récompensée par le prix Nobel de physiologie-médecine 2015.
Cependant, des foyers de parasites résistants à l'artémisinine apparaissent, ce qui pose la question du mode d'action de cette molécule. De précédentes publications (1) ont proposé que l'artémisinine aurait pour cible l'ATPase-Ca2+ du parasite (une protéine qui transporte l'ion calcium, Ca2+, dans les organites intracellulaires). L'artémisinine conduirait à la mort du parasite en inhibant cette protéine.
Ces publications ont entraîné un grand nombre d'études, en particulier des séquençages de génomes du parasite dans les régions confrontées à la présence de foyers de résistance. Or, des scientifiques de l'Institut de biologie intégrative de la cellule (Université Paris-Sud/ CEA/ CNRS), en collaboration avec une équipe danoise (Pumpkin, Université d'Aarhus), avaient déjà mis au point un système d'expression dans la levure pour étudier la fonction de la protéine suspectée être la cible de l'artémisinine (2). Dans ce système, l'artémisinine n'avait aucun effet sur l'activité de l'ATPase-Ca2+, suggérant fortement que cette enzyme n'est pas la cible de l'artémisinine.
Dans une nouvelle étude, les chercheurs ont mis au point l'expression de l'ATPase-Ca2+ dans les ovocytes de la grenouille Xénope ce qui n'a pas non plus permis de montrer le moindre effet de l'artémisinine sur l'activité de l'ATPaseCa2+.
Notes :
(1) Articles publiés dans les périodiques Nature et Nature Structural and Molecular Biology principalement par des laboratoires anglais.
(2) Cardi D, Pozza A, Arnou B, Marchal E, Clausen JD, Andersen JP, Krishna S, Møller JV, le Maire M, Jaxel C. Purified E255L mutant SERCA1a and purified PfATP6 are sensitive to SERCA-type inhibitors but insensitive to artemisinins. J. Biol Chem 2010.
(3) voir par exemple: Mbengue A, Bhattacharjee S, Pandharkar T, Liu H, Estiu G, Stahelin RV, Rizk SS, Njimoh DL, Ryan Y, Chotivanich K, Nguon C, Ghorbal M, Lopez-Rubio JJ, Pfrender M, Emrich S, Mohandas N, Dondorp AM, Wiest O, Haldar K. A molecular mechanism of artemisinin resistance in Plasmodium falciparum malaria Nature 2015.
(4) L'artémisinine inhiberait une phosphatidylinositol-3-kinase. Une mutation de la protéine Kelch 13 empêcherait la dégradation de la kinase et entraîne une résistance à l'artémisinine.