Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
En travaillant sur une sulfite déshydrogénase issue d'une bactérie hyper-thermophile, des chercheurs du BIP à Marseille, en collaboration avec une équipe irlandaise, ont réussi à piéger et à caractériser à l'échelle atomique la structure d'un adduit Mo-phosphate mimant un intermédiaire réactionnel postulé mais jamais détecté dans ce type de molybdoenzymes. Publiés dans la revue ChemComm, ces travaux ouvrent de nouvelles perspectives dans l'exploration détaillée du mécanisme moléculaire de conversion du sulfite en sulfate chez les êtres vivants.
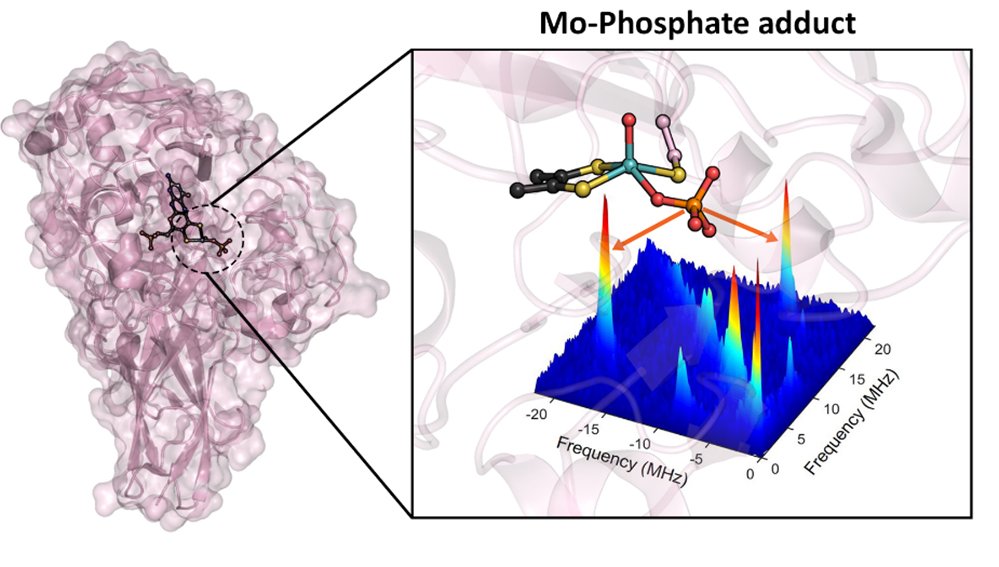
© Royal Society of ChemistryFigure: Structure 3D de la sulfite déshydrogénase résolue par diffraction des rayons X en présence de phosphate de sodium. Cette structure montre un adduit Mo-phosphate dans son site actif identifié par ailleurs par l'analyse du spectre de Résonance Paramagnétique Electronique avancée du noyau 31P montré dans l'encart. Reproduit avec la permission de la Royal Society of Chemistry.
Les composés soufrés jouent un rôle crucial pour de nombreuses réactions cellulaires mais leur réactivité peut les rendre toxiques. C'est en particulier le cas du sulfite qui peut causer des dommages oxydatifs aux protéines, aux acides nucléiques et aux lipides conduisant à des préjudices cellulaires irréversibles. Cependant, la plupart des organismes vivants produisent des enzymes capables de convertir efficacement le sulfite en sulfate, moins délétère. Ces oxydoréductases portent le nom générique de sulfite oxydases (SO) et possèdent toutes un site actif contenant un cofacteur à molybdène (Mo) requis pour la catalyse. La SO humaine est par exemple indispensable à la métabolisation des acides aminés soufrés absorbés avec l'alimentation. Une carence en cette enzyme due par exemple à l'absence de cofacteur à Mo est létale chez les nouveaux nés.
Par ailleurs, de nombreux microorganismes procaryotes sont capables de tirer profit de la réaction de conversion du sulfite en sulfate pour leur métabolisme énergétique. Ils synthétisent pour cela des enzymes appelées sulfite déshydrogénases (SDH). Alors que l'examen des quelques structures atomiques disponibles de SO et de SDH révèle des structures de leur cofacteur à molybdène quasi-identiques, le mécanisme moléculaire détaillé permettant la conversion du sulfite en sulfate par ces enzymes reste largement incompris.
En utilisant comme organisme source la bactérie hyper-thermophile Thermus thermophilus, des chercheurs du laboratoire de Bioénergétique et Ingénierie des Protéines (BIP) à Marseille en collaboration avec une équipe de l'Université de Limerick en Irlande ont pu caractériser la structure atomique d'une SDH en présence de phosphate, un analogue du produit de la réaction. En combinant des approches de cristallographie par diffraction des rayons X, de spectroscopie de Résonance Paramagnétique Electronique avancée et de modélisation moléculaire de chimie quantique, ces chercheurs ont démontré la stabilisation inédite d'un adduit Mo-phosphate, et ont résolu les détails structuraux de cette stabilisation. Un tel adduit mime un intermédiaire réactionnel postulé mais jamais démontré chez les SO/SDH. Ce travail fournit ainsi une base solide pour décrypter au niveau moléculaire le mécanisme biologique de conversion du sulfite en sulfate chez les êtres vivants et permet d'unifier plusieurs décennies de recherche sur cette classe d'enzymes, qu'elles soient d'origine eucaryote ou procaryote.
Pour en savoir plus:
Structural evidence for a reaction intermediate mimic in the active site of a sulfite dehydrogenase.
Ahmed Djeghader, Melanie Rossotti, Saleh Abdulkarim, Frédéric Biaso, Guillaume Gerbaud, Wolfgang Nitschke, Barbara Schoepp-Cothenet, Tewfik Soulimane, Stéphane Grimaldi.
Chemical Communications, 2020, DOI:10.1039/d0cc03634j.
Laboratoire:
Bioénergétique et ingénierie des protéines (BIP) - (CNRS/Université Aix-Marseille) - 31 Chemin Joseph Aiguier.- 13402 MARSEILLE CEDEX 20.
Contacts:
- Stéphane Grimaldi - Enseignant- chercheur à l'Université Aix-Marseille et au laboratoire Bioénergétique et ingénierie des protéines (BIP) - stephane.grimaldi at univ-amu.fr
- Barbara Schoepp-Cothenet - Chercheuse au laboratoire Bioénergétique et ingénierie des protéines (BIP) - schoepp at imm.cnrs.fr