Site actif - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
Le site actif désigne en catalyse la partie du catalyseur qui va interagir avec le(s) substrat(s) pour former le(s) produit(s). Cette notion concerne tous les types de catalyseurs mais on l'associe généralement aux enzymes. Le site actifs des catalyseurs fait l'objet d'études poussées dans le cadre de la recherche de nouveaux catalyseurs et de l'étude des mécanismes réactionnels en biochimie.
Définition
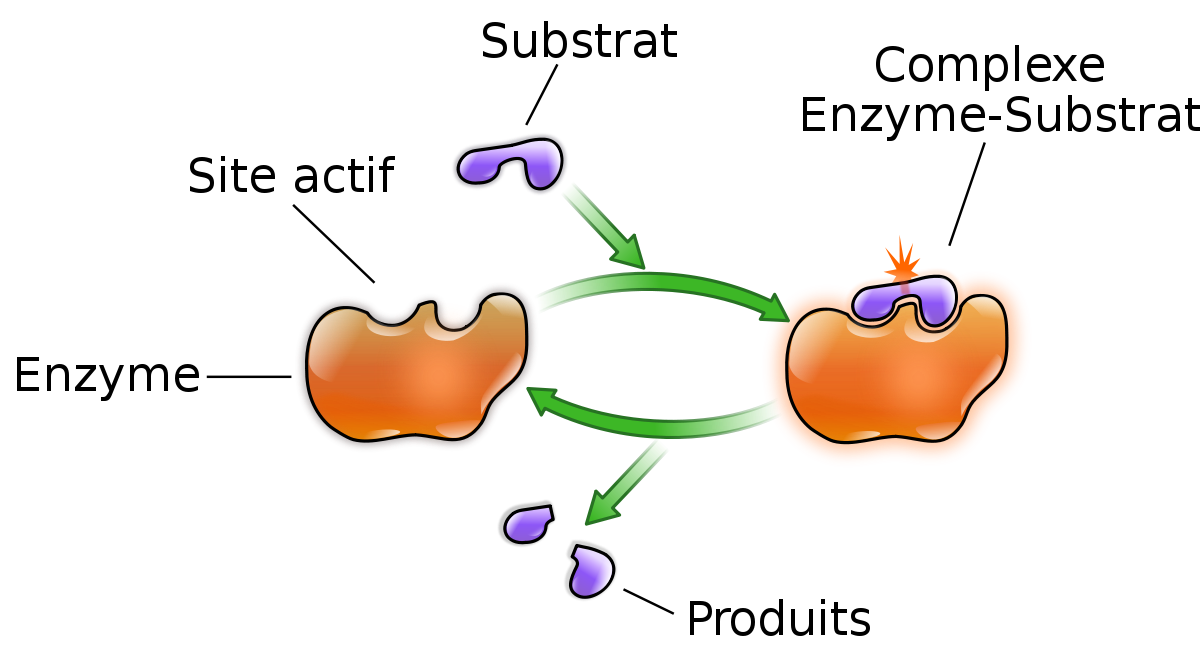
La fonction des enzymes est liée à la présence dans leur structure d'un site particulier appelé le site actif qui a la forme d'une cavité ou d'un sillon. Les molécules sur lesquelles agit une enzyme sont définies comme les substrats de la réaction enzymatique. Chaque enzyme « reconnaît » spécifiquement une ou plusieurs molécules de substrat selon un principe de complémentarité de type clé-serrure, d'après la projection de Fischer, grâce à des sites de reconnaissance et de fixation situés à sa surface. Ce modèle statique a été affiné, par exemple en modèle dynamique, où l'enzyme n'est plus complémentaire de son substrat dans son état fondamental, mais dans son état actif : le substrat modifie légèrement la conformation de l'enzyme. C'est ce qu'on appelle l'ajustement induit de Koshland, bien étudié dans le cas des hexokinases par exemple (voir l'article allostérie).
D'autres modèles tiennent compte de spécificités des enzymes, tels que l'ajustement du substrat à la forme du site actif par exemple (l'adaptation du substrat aurait pour conséquence une torsion de celui-ci, défavorable énergétiquement en l'absence de l'enzyme, mais qui faciliterait dans ce contexte la réaction chimique : modèle de Jenks) ou un ajustement imparfait permettant une vitesse de réaction modérée. Dans tous les cas, la fixation du substrat sur l'enzyme a pour conséquence la formation du complexe enzyme-substrat, ou complexe E/S, indispensable à la réaction enzymatique. Cette dernière fait intervenir les acides aminés d'un site catalytique. L'enzyme peut alors accélérer considérablement une des réactions biochimiques faisant intervenir ce substrat. À la fin de la réaction, l'enzyme est intacte et peut intervenir sur une autre molécule de substrat. Pendant la réaction, le substrat a pu être transformé en produit de la réaction.
Il est constitué de deux parties :
- Le site de reconnaissance (ou site de liaison au substrat); permettant de fixer le substrat grâce à certains acides aminés
- Le site catalytique (où a lieu la transformation du substrat);permettant de transformer le substrat grâce à des acides aminés qui interagissent avec le substrat.