Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
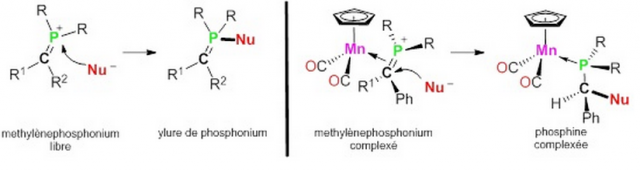
A l'état libre, le cation méthylènephosphonium va réagir avec un nucléophile (Nu-) exclusivement au niveau de l'atome de phosphore chargé positivement pour conduire à un ylure de phosphonium (partie gauche du schéma). Lorsque le cation méthylènephosphonium est engagé dans une liaison de coordination avec un atome de manganèse (partie droite du schéma), l'attaque du nucléophile s'effectue exclusivement au niveau de l'atome de carbone, induisant la formation d'une phosphine chirale. On voit bien l'importance du métal dans cette réaction, et c'est en fait la grande stabilité thermodynamique du produit final, le complexe de phosphine, qui va orienter la réaction dans ce sens.
Au-delà de l'aspect fondamental, ce résultat présente également deux intérêts
Tout d'abord, la synthèse de sels de méthylènephosphonium libres peut être dissuasive compte tenu des difficultés de manipulation de cette espèce très réactive. En présence du complexe de manganèse, le cation méthylènephosphonium n'est jamais manipulé en tant que tel puisqu'il est engagé dans la sphère de coordination du métal, le complexe résultant étant parfaitement stable à l'air et pratiquement insensible à l'humidité.
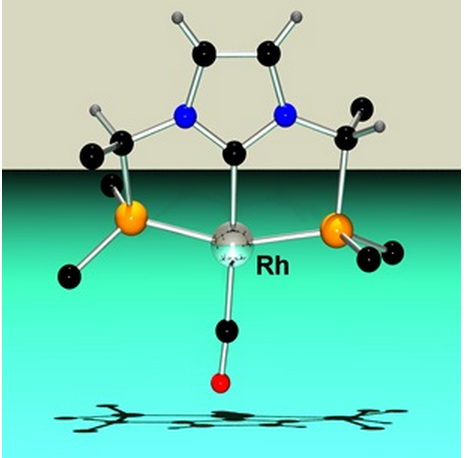
Vue en perspective du squelette d'un complexe de Rh(I) impliquant un des ligands pince chiraux
© Noël Lugan
De plus, comme le montre le schéma, la molécule cible – une phosphine chirale – est obtenue sous forme complexée avec le métal, donc protégée. Cependant, elle peut être libérée à la demande par simple exposition à la lumière visible. Le métal est ainsi éliminé mais le procédé reste économiquement viable dans la mesure où le manganèse est un métal très abondant (3ème métal de transition le plus abondant de la croute terrestre derrière le fer et le titane), et le complexe de manganèse à la base de cette chimie, CpMn(CO)3, est produit à l'échelle industrielle comme antidétonant pour essence automobile.
L'intérêt du procédé réside également dans la diversité des réactifs auxquels il peut s'appliquer, tant pour les complexes de méthylènephosphonium envisageables que les nucléophiles utilisables. Ainsi, l'utilisation d'un imidazole comme nucléophile a conduit à la synthèse de phosphines pinces chirales à motif phosphine-NHC-phosphine inédits, dont les premiers complexes du Rh(I) viennent d'être décrits et dont les propriétés catalytiques restent encore à explorer.
Référence:
Dmitry A. Valyaev, Oleg A. Filippov, Noël Lugan, Guy Lavigne, Nikolai A. Ustynyuk
Umpolung of Methylenephosphonium Ions in their Manganese Half-Sandwich Complexes and Application to the Synthesis of Chiral Phosphorus-Containing Ligand Scaffolds
Angew. Chem. Int. Ed. 1 avril 2015
doi: 10.1002/anie.201501256R1