Des enzymes bactériennes pour convertir le CO2 en source d'énergie
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
© A. Magalon
La description du mécanisme d'activation de ces enzymes, les formiate déshydrogénases (2) (FDHs), représente une avancée importante pour développer, à terme, des biotechnologies appliquées aux énergies renouvelables.
Ces résultats sont publiés dans la revue Nature Communications.
Les formiate déshydrogénases (FDHs) sont des enzymes qui transforment le CO2 en acide formique (CH2O2) chez de nombreuses bactéries. Ce dernier est utilisé pour alimenter certaines piles à combustibles ou pour stocker de l'hydrogène, ce qui fait de lui un composé d'un grand intérêt dans le domaine des énergies renouvelables.
La transformation du CO2 en acide formique requiert des enzymes FDHs sous forme active. Leur activation passe par la fixation d'un atome de soufre (sulfuration) sur un composé, appelé cofacteur à molybdène, qui s'intègrera ensuite dans le site actif des FDHs. Plus précisément, l'atome de soufre est conduit jusqu'au cofacteur par une protéine chaperon (3), dont le mode d'action, déterminant pour activer les FDHs et donc transformer le CO2, était jusqu'alors inconnu.
Des chercheurs du CEA, du CNRS et d'Aix-Marseille Université ont réussi à décrypter le mécanisme de "sulfuration" du cofacteur à molybdène chez la bactérie Escherichia coli grâce à une approche multidisciplinaire associant des techniques de biologie structurale, de biochimie et de biologie moléculaire. D'une part, ce cofacteur est une molécule très fragile, de l'autre, le soufre inorganique est hautement réactif. Dans ce contexte, il a été mis en évidence un mécanisme permettant de coupler le transfert protégé du soufre et la fixation du cofacteur à molybdène sur une même protéine chaperon. Selon le modèle décrit par les chercheurs, le soufre navigue à travers un tunnel traversant le coeur de la protéine chaperon, tunnel qui relie d'un côté la protéine donneuse de soufre et de l'autre, le cofacteur à molybdène. Le cofacteur ainsi soufré peut s'intégrer dans le site actif des FDHs: ces enzymes sont dès lors capables de catalyser la transformation du CO2 en acide formique.
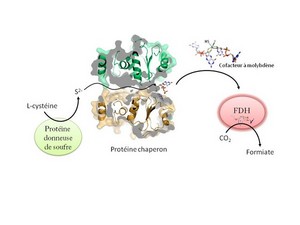
Sur cette figure, le soufre produit à partir de L-Cystéine navigue à travers un tunnel traversant la protéine chaperon pour atteindre le cofacteur à molybdène fixé de l'autre côté de la protéine. Une fois le cofacteur à molybdène soufré, celui-ci est disponible pour les FDHs et permet ainsi leur activité. © A. Magalon
Ces travaux permettent une meilleure compréhension d'une étape clé dans la production de FDHs sous forme active et offrent de belles perspectives dans le développement d'applications en biotechnologies dans le domaine des énergies renouvelables.
Rappel
Il existe actuellement plusieurs types de piles à combustibles. Certaines sont composées d'une membrane échangeuse de protons qui permet, à partir d'acide formique et d'oxygène, de créer de l'énergie en rejetant notamment de l'eau et du CO2. On parle de "direct formic acid fuel cell".
Grâce à la réduction du CO2 en acide formique via le rôle clé joué par les formiate déshydrogénases, il serait possible d'alimenter des piles à combustibles et ainsi favoriser l'utilisation d'énergies renouvelables.
Notes:
(1) Institut de biologie environnementale et biotechnologie.
(2) Les formiate déshydrogénases sont un ensemble d'enzymes qui catalyse l'oxydation du formiate de dioxyde de carbone.
(3) Protéine dont le rôle est d'assister d'autres protéines pour favoriser leur maturation.