Valorisation durable du CO2 comme carburant: une avancée majeure
Publié par Redbran,
Source: CNRS INCAutres langues:
Source: CNRS INCAutres langues:
1
Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)

Image d'illustration Pixabay
Faire du dioxyde de carbone (CO2) une source renouvelable et durable de carbone est un défi majeur pour la recherche scientifique et un enjeu politique de premier plan. La nature a déjà eu cette idée puisqu'elle transforme le CO2 et l'eau en glucose grâce à l'énergie du soleil via la photosynthèse: une forme remarquable de stockage d'énergie. La recherche s'en inspire pour mettre au point des procédés photo-électrochimiques capables de convertir le CO2 en un large éventail de molécules organiques à haute valeur ajoutée comme l'acide formique, le méthane, le méthanol ou l'éthanol.
Au cours de ces processus, la molécule de CO2 perd progressivement ses atomes d'oxygène qui sont remplacés par des atomes d'hydrogène, stockant au passage de l'énergie sous forme de liaisons chimiques. Cette transformation, dite "réaction de réduction", nécessite de l'énergie mais également des catalyseurs actifs, sélectifs et durables pour vaincre la très grande stabilité des liaisons C-O et ne favoriser que la réduction souhaitée, en méthanol par exemple, parmi les nombreuses réactions possibles. Un point crucial qui ralentit fortement le déploiement de ces solutions très attractives.
Dans ce contexte, des scientifiques du Laboratoire d'électrochimie moléculaire (LEM, CNRS/Université Paris Cité), en collaboration avec des équipes chinoises, ont mis au point un catalyseur modèle à atome de Cobalt (Co) unique avec une structure de coordination bien définie pour étudier le mécanisme sous-jacent des réactions de réduction du CO2 mais aussi du CO (monoxyde de carbone) en méthanol. Le complexe moléculaire de cobalt choisi est la phtalocyanine de cobalt. En présence de CO2, le processus de réduction s'arrête à la formation de CO et la production de méthanol est infime. Par contre, en présence de CO seul, la réduction de ce dernier en méthanol se fait de façon sélective et avec un très bon rendement.
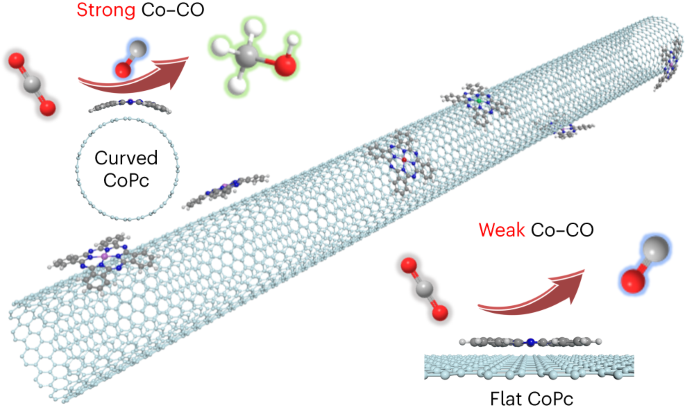
L'utilisation d'un catalyseur moléculaire de cobalt ancré à la surface courbe de nanotubes de carbone favorise la réduction sélective du CO2 en méthanol avec des rendements élevés. Cette même réduction n'est pas favorisée si le catalyseur est sur une surface plane.
© Marc Robert
Les scientifiques ont montré que ce mécanisme, lié au trop faible temps de séjour du CO à la surface du catalyseur en présence de CO2, pouvait être contourné en jouant sur la géométrie du support du catalyseur. En effet, une fois ancré à la surface de nanotubes de carbone, la disposition contrainte et fortement courbée des molécules de catalyseur favorise l'interaction entre atomes de cobalt et molécules de CO. Cette interaction forte se traduit par un plus long temps de séjour qui favorise la poursuite du processus de réduction du monoxyde de carbone en méthanol avec un rendement élevé.
Ces résultats ont fait l'objet d'une double publication dans les revues Nature Catalysis et Nature Communications. Ils devraient permettre l'optimisation et le développement de catalyseurs moléculaires à base de métaux non critiques particulièrement actifs et sélectifs pour produire du méthanol à partir du CO2 issu de fumées industrielles, voire de sources moins concentrées.
Références
In-situ spectroscopic probe of the intrinsic structure feature of single-atom center in electrochemical CO/CO2 reduction to methanol
Xinyi Ren, Jian Zhao, Xuning Li, Junming Shao, Binbin Pan, Aude Salamé, Etienne Boutin, Thomas Groizard, Shifu Wang, Jie Ding, Xiong Zhang, Wen-Yang Huang, Wen-Jing Zeng, Chengyu Liu, Yanguang Li, Sung-Fu Hung, Yanqiang Huang, Marc Robert & Bin Liu.
Nature Communications 2023
https://doi.org/10.1038/s41467-023-39153-6.
Strain enhances the activity of molecular electrocatalysts via carbon nanotube supports
Jianjun Su, Charles B. Musgrave, Yun Song, Libei Huang, Yong Liu, Geng Li, Yinger Xin, Pei Xiong, Molly Meng-Jung Li, Haoran Wu, Minghui Zhu, Hao Ming Chen, Jianyu Zhang, Hanchen Shen, Zhong Tang, Marc Robert, William A. Goddard & Ruquan Ye.
Nature Catalysis 2023
https://doi.org/10.1038/s41929-023-01005-3.