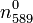Dioxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Dioxyde de carbone | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Général | |||||||
| Nom IUPAC | |||||||
| Synonymes | gaz carbonique Anhydride carbonique | ||||||
| No CAS | |||||||
| No EINECS | |||||||
| No E | E290 | ||||||
| SMILES | |||||||
| InChI | |||||||
| Apparence | gaz comprimé liquéfié, incolore, inodore. | ||||||
| Propriétés chimiques | |||||||
| Formule brute | CO2 | ||||||
| Masse molaire | 44,0095 ± 0,0014 g·mol-1 | ||||||
| Propriétés physiques | |||||||
| T° fusion | -78,48 °C (sublimation, 760 mmHg) | ||||||
| T° ébullition | -56,6 °C (5,2 atm) | ||||||
| Solubilité | dans l'eau à 20 °C : 88 mL/100 mL | ||||||
| Masse volumique | 1,87 kg·m-3 plus dense que l'air | ||||||
| Pression de vapeur saturante | 5 720 kPa (20 °C) 569,1 mmHg (-82 °C); | ||||||
| Viscosité dynamique | 0,07 mPa·s à -78 °C | ||||||
| Point critique | 31,3 °C; 72,9 atm; 0,464 g·cm-3 | ||||||
| Point triple | -56,6 °C à 5,11 atm | ||||||
| Thermochimie | |||||||
| ΔH0 | -393,52 kJ·mol-1 | ||||||
| Cp | |||||||
| Propriétés électroniques | |||||||
| 1re énergie d'ionisation | 13,773 ± 0,002 eV (gaz) | ||||||
| Cristallographie | |||||||
| Classe cristalline ou groupe d’espace | P42/mnm | ||||||
| Paramètres de maille | a = 3,535 Å b = 3,535 Å | ||||||
| Volume | 51,73 Å3 | ||||||
| Propriétés optiques | |||||||
| Indice de réfraction |
| ||||||
| Précautions | |||||||
| | |||||||
| Phrases S : 9, 23, 36, | |||||||
| | |||||||
| |||||||
| | |||||||

| |||||||
| | |||||||
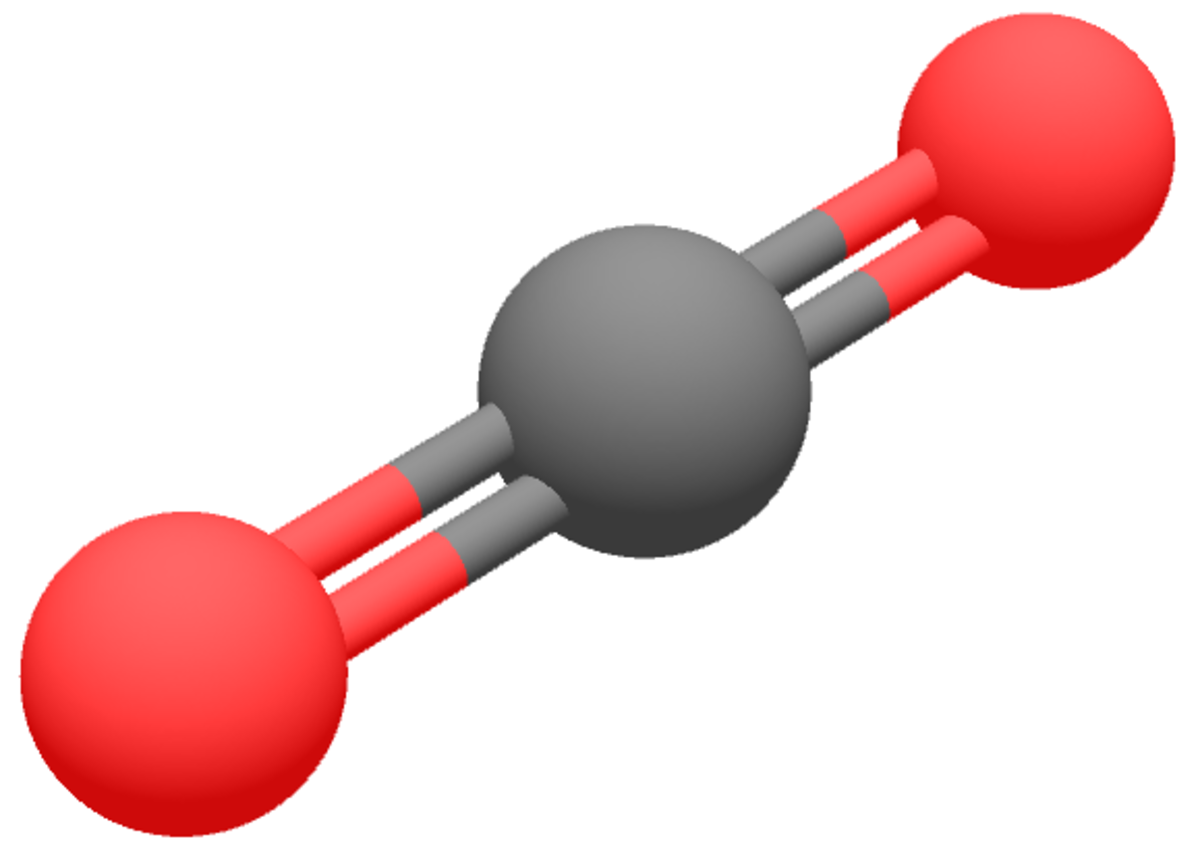
Le dioxyde de carbone, communément appelé gaz carbonique ou anhydride carbonique, est un composé chimique composé d'un atome de carbone et de deux atomes d'oxygène et dont la formule brute est : CO2. C'est donc un oxyde de carbone.
Cette molécule linéaire a pour formule développée : O=C=O.
Dans les conditions normales de température et de pression, le dioxyde de carbone est un gaz incolore, inodore et à la saveur piquante.
Il est présent dans l'atmosphère dans une proportion approximativement égale à 0,0375 % en volume, au début du XXIe siècle soit 375 ppmv (parties par million en volume). En 2009, cette proportion atteint 386 ppm.
Il est produit notamment lors de la fermentation aérobie ou de la combustion de composés organiques, et lors de la respiration des animaux ainsi que des végétaux. Pour ces derniers, la photosynthèse absorbe beaucoup plus de CO2 que leur respiration n’en produit.