Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
Les glycopeptides et les glycoprotéines sont des conjugués composés d'un sucre lié à une chaîne d'acides aminés (peptide) ou à une protéine. Ils constituent l'architecture moléculaire de nombreuses biomolécules et ils sont largement présents dans tous les organismes vivants. Cette omniprésence les rend indispensables notamment en médecine mais la liaison du sucre au peptide/protéine peut se faire dégrader par les enzymes présentes dans le vivant. Pour suivre un glycoconjugé particulier ou pour délivrer un glycocon jugé à usage médical, il faut donc le rendre inattaquable par ces enzymes. Ce que des chimistes du laboratoire de Biomolécule-Conception, Isolement et Synthèse (CNRS/Université Paris-Sud) et du Centre de Biophysique Moléculaire (CNRS) viennent de réaliser avec une méthode plus simple qu'auparavant.
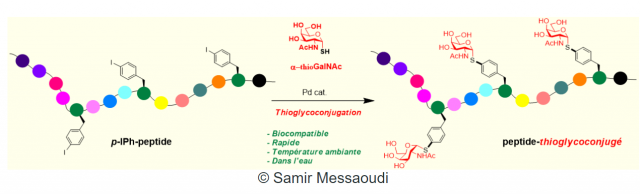
Une technique classique pour rendre les conjugués stables est de remplacer l'oxygène qui lie la partie sucre au peptide/protéine par un atome de soufre. L'analogue ainsi formé est appelé un thioglycoconjugé (thio- pour soufre) et c'est un excellent mime des glycoconjugés, tout en restant stable. Problème: la transformation pour l'obtenir nécessite de nombreuses étapes de synthèse, notamment des étapes complexes de protection et déprotection des différentes fonctions des molécules à conjuguer.
En une seule étape, dans de l'eau à pH neutre et à température ambiante, l'équipe de parisiens et d'orléanais fait bien mieux que la méthode classique. En utilisant de acides aminés possédant un noyau aromatique iodé comme point d'ancrage, en présence d'un catalyseur au palladium, ils obtiennent des thioglycoaminoacides, "briques moléculaires" des peptides complexes. Au final, cette méthode a pu être utilisée pour synthétiser un long thioglycopeptide de 60 acides aminés. Cette facilité d'accès ouvre la voie à une multitude de nouvelles molécules inédites, capables de mimer les glycoprotéines impliquées dans diverses pathologies.
Référence publication:
David Montoir, Mehdi Amoura, Zine El Abidine Ababsa, T. M. Vishwanatha, Expédite Yen-Pon,
Vincent Robert, Massimiliano Beltramo, Véronique Piller, Mouad Alami, Vincent Aucagne et Samir Messaoudi
Synthesis of Aryl-Thioglycopeptides Through Chemoselective Pd-Mediated Conjugation
Chemical Science – Septembre 2018
DOI: 10.1039/C8SC02370K
Contacts chercheur:
Samir Messaoudi, BioCIS UMR8076, Université Paris-Sud, Université Paris-Saclay