Restez toujours informé: suivez-nous sur Google Actualités (icone ☆)
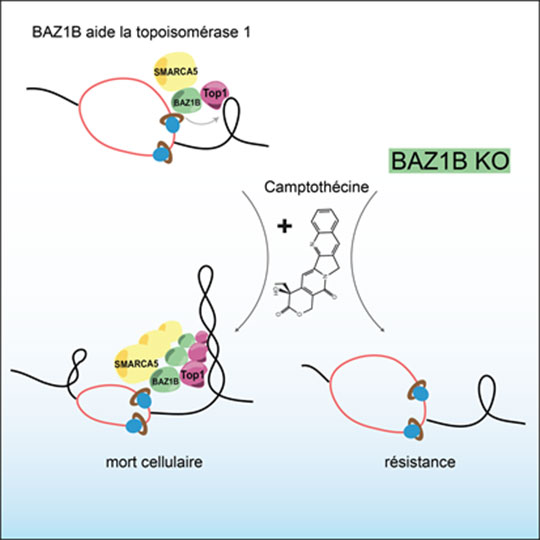
Figure: Le complexe WICH (BAZ1B-SMARCA5) facilite l'action de la topoisomérase I durant la réplication. La camptothécine cible la topoisomérase I, ce qui conduit à la formation de lésions de l'ADN durant la réplication puis à la mort cellulaire, principalement dans les cellules cancéreuses. En absence de BAZ1B, la topoisomérase I n'est plus localisée au niveau des fourches de réplication, ce qui entraine une résistance à la camptothécine du fait de l'absence de sa cible.
© Cyril Ribeyre. Angelos Constantinou
La molécule d'ADN, support de l'information génétique, subit une phase de duplication permettant la transmission à la descendance. Cette étape est réalisée par une machinerie enzymatique spécialisée, le réplisome, qui va copier chaque brin de la double-hélice. L'ouverture de la double-hélice et la progression du réplisome génère de fortes contraintes physiques dans la molécule l'ADN, appelées contraintes topologiques. De la même façon, la transcription, processus permettant l'expression des caractères génétiques, soumet la molécule d'ADN au même type de contraintes. Des enzymes hautement conservées, les ADN topoisomérases, sont présentes chez tous les organismes vivants (eucaryotes, bactéries, archaebactéries et virus) et relâchent les contraintes topologiques de la molécule d'ADN par un mécanisme en deux étapes. Dans un premier temps la topoisomérase crée une cassure d'un seul brin (Type 1) ou des deux brins (Type 2) de la molécule d'ADN. Ensuite, l'enzyme recolle les brins de sorte que l'intégrité de la molécule d'ADN est restaurée. De par leur rôle fondamental, ces enzymes sont la cible de nombreux traitements antibiotiques et chimiothérapeutiques.
La camptothécine est un inhibiteur de la topoisomérase 1 dont les dérivés (topotecan et ironotecan) sont utilisés en routine pour traiter les cancers du côlon et de l'ovaire. Cette molécule issue d'une plante (Camptotheca acuminata) est extrêmement spécifique: une mutation dans le gène de la topoisomérase 1 abroge son effet. La camptothécine empêche la phase de religation de la topoisomérase ce qui conduit à un blocage physique de l'ADN sur son substrat et à l'apparition de lésions de l'ADN. Il a été montré, il y a plus de 25 ans, que la toxicité de la camptothécine vis-à-vis des cellules cancéreuses est due à son action inhibitrice sur la réplication de l'ADN. Néanmoins, des phénomènes de résistance sont rencontrés chez les patients traités.
Afin de mieux comprendre comment la camptothécine affecte la réplication, Cyril Ribeyre, dans l'équipe d'Angelos Constantinou, a utilisé une méthode permettant d'analyser de manière systématique les protéines à proximité des fourches de réplication en présence de camptothécine. Cette approche a permis d'identifier une cinquantaine de protéines spécifiquement enrichies au niveau des fourches de réplication en réponse à l'exposition des cellules à la camptothécine. Parmi les protéines identifiées, leur attention s'est portée sur BAZ1B et SMARCA5. Ces protéines forment le complexe de remodelage de la chromatine WICH qui limite la formation d'hétérochromatine durant la réplication. Leurs expériences montrent que la protéine BAZ1B facilite l'accès de la topoisomérase I au niveau du réplisome. En absence de BAZ1B, l'effet de la camptothécine sur la progression des fourches de réplication est très diminué et les cellules deviennent plus tolérantes à la drogue. Cyril Ribeyre et Angelos Constantinou ont ainsi mis à jour un complexe protéique nécessaire à l'action de la topoisomérase I durant la réplication. Cette découverte a des implications sur le plan thérapeutique. La protéine BAZ1B pourrait servir de biomarqueur prédictif de la réponse d'une tumeur à un traitement par des dérivés de la camptothécine. La prolifération d'une tumeur exprimant fortement BAZ1B aura plus de chance d'être inhibée par la camptothécine. Réciproquement, l'inactivation de BAZ1B pourrait prédire la résistance d'une tumeur au traitement. Cette hypothèse reste à vérifier dans le contexte clinique et une question, parmi d'autres, reste encore en suspens: comment BAZ1B régule-t-elle l'action de la topoisomérase I ? Cette dernière interagit avec BAZ1B, mais les mécanismes moléculaires demeurent encore mal compris et devront être précisés dans les années à venir.