Monoxyde de carbone - Définition
La liste des auteurs de cet article est disponible ici.
Introduction
| Monoxyde de carbone | |||
|---|---|---|---|
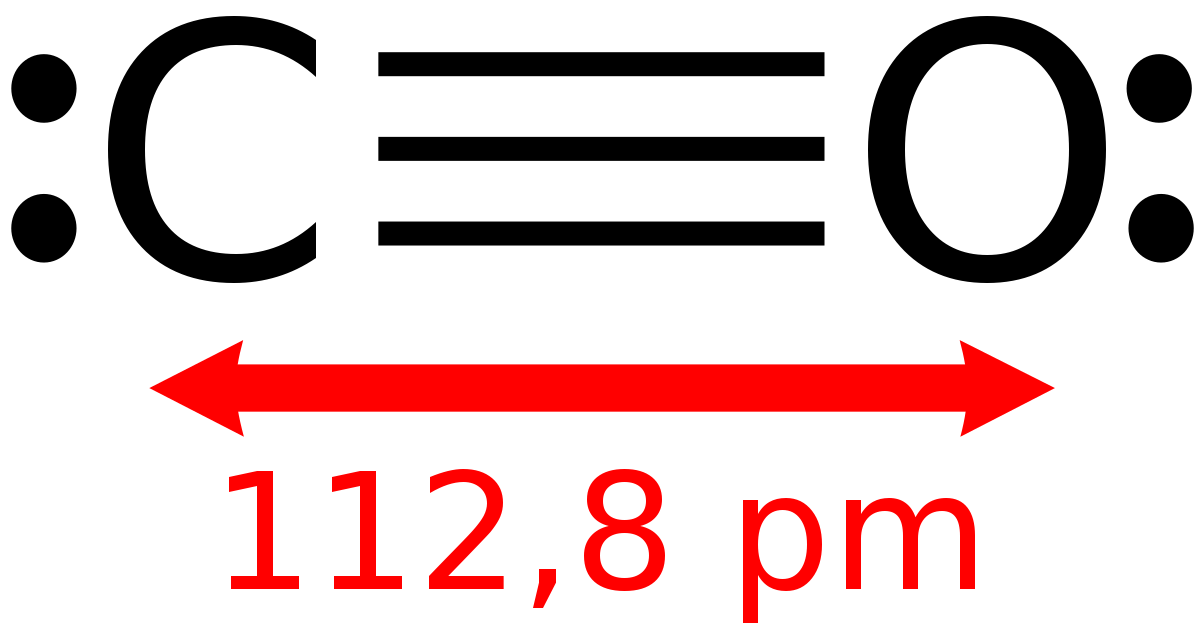
| |||
| Général | |||
| No CAS | |||
| Apparence | gaz comprimé incolore, inodore, insipide. | ||
| Propriétés chimiques | |||
| Formule brute | CO | ||
| Masse molaire | 28,0101 ± 0,0011 g·mol-1 | ||
| Moment dipolaire | 0,10980 D | ||
| Propriétés physiques | |||
| T° fusion | -205 °C | ||
| T° ébullition | -191 °C | ||
| Solubilité | dans l'eau à 20 °C : 2.3 ml/100 ml | ||
| Masse volumique | 1,145 (gaz à 298K) | ||
| T° d’auto-inflammation | 605 °C | ||
| Point d’éclair | Gaz Inflammable | ||
| Limites d’explosivité dans l’air | 12,5–74,2 %vol | ||
| Pression de vapeur saturante | |||
| Point critique | -140,05 °C, 35,0 MPa | ||
| Thermochimie | |||
| S0 | -110,53 kJ/mol | ||
| ΔH0 | -110,53 kJ·mol-1 | ||
| Cp | |||
| PCI | 283,4 kJ·mol-1 | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 14,014 ± 0,0003 eV (gaz) | ||
| Cristallographie | |||
| symbole de Pearson | cP8 | ||
| Classe cristalline ou groupe d’espace | P213 (n°198) | ||
| Strukturbericht | B21 | ||
| Précautions | |||
| | |||
| |||
| Phrases R : 12, 23, 48/23, 61, | |||
| Phrases S : 45, 53, | |||
| | |||
| |||
| | |||



| |||
| | |||



Danger | |||
| Inhalation | Très dangereuse, mortelle | ||
| Ingestion | Cause possible de nausée et vomissements | ||
| | |||
Le monoxyde de carbone est un des oxydes du carbone. Sa formule brute s'écrit CO et sa formule semi-développée C=O ou –C≡O+, la molécule est composée d'un atome de carbone et d'un atome d'oxygène. Ce corps composé est à l'état gazeux dans les conditions normales de pression et de température.
Le monoxyde de carbone a été et reste un gaz industriel. Rappelons que le monoxyde de carbone CO participe à la combustion : les fours à gazogène à la fin du dix-neuvième siècle, du type générateurs Siemens, le brûlent essentiellement. Il reste un grand combustible, un agent réducteur ou d’addition industriel.
Le monoxyde de carbone est incolore, inodore et très toxique pour les mammifères. Il est la cause d’intoxications domestiques extrêmement fréquentes, parfois mortelles en cas d'absence de détection ou de survenue brutale dans l'air respirable de l'homme.
Son émanation provient d'une combustion incomplète et est accentuée par une mauvaise alimentation en air frais et/ou une mauvaise évacuation des produits de combustion (ventilation). Le mélange avec l’air est facile puisque sa densité est proche de celle de l’air. Ce gaz ici indésirable résulte de la combustion de matière carbonée dans des conditions spécifiques de combustion incomplète. L'oxygénation du foyer reste insuffisante pour brûler complètement les gaz formés à partir de la matière, mais la réaction est assez exothermique pour élever et maintenir la température au delà de 950 °C. Le monoxyde de carbone se forme alors préférentiellement au dioxyde de carbone, selon l'équilibre de Boudouard. En dessous de ce seuil, la molécule CO est métastable, a fortiori à température et pression ambiantes. Elle se décompose toutefois très lentement, et surtout au contact de surfaces pour former du dioxyde de carbone et du carbone. C'est selon cette réaction réversible que le carbone est transporté au cœur des procédés sidérurgiques ou, plus surprenant, au cœur de mécanismes biochimiques in vivo.